20/11/24 Market Watch: Viking Therapeutics è più di un semplice titolo per la perdita di peso, e questo sta attirando applausi
Viking Therapeutics Inc. ha vinto i convogli mercoledì, non per la sua pillola per l’obesità che ha generato una notevole eccitazione tra gli investitori, ma per l’altro prodotto candidato chiave nella sua pipeline: un trattamento per la malattia del fegato MASH.
MASH, o steatoepatite associata a disfunzione metabolica, è una grave malattia del fegato causata da un accumulo di grasso che si infiamma nonostante una bassa assunzione di alcol. Precedentemente era nota come NASH, o steatoepatite non correlata all’alcol.
La malattia colpisce circa 22 milioni di americani, secondo l’American Managed Care Pharmacy Association, e può portare a malattie del fegato allo stadio terminale, cancro al fegato e persino la morte. È diventato il motivo più comune per i trapianti di fegato negli Stati Uniti.
Viking martedì ha tenuto una presentazione alla riunione dell’American Association for the Study of Liver Diseases a San Diego, descrivendo in dettaglio i dati completi del suo studio di fase 11b del suo prodotto candidato VK2809 in pazienti MASH.
Gli analisti di William Blair erano ottimisti sui dati.
“Siamo impressionati dalla dimostrazione di un miglioramento statisticamente significativo e clinicamente significativo nell’endpoint approvato dalla FDA del beneficio della fibrosi alla dose più alta, insieme alla risoluzione MASH su tutte le dosi”, hanno scritto gli analisti guidati da Andy T. Hsieh in una nota ai clienti mercoledì.
La fibrosi è la cicatrizzazione del tessuto epatico che si verifica nel MASH e può portare a problemi come la cirrosi se non trattata. I dati suggerivano che il beneficio era consistente nonostante la fase di fibrosi, “che a nostro avviso fa ben sperare per il programma pivot che probabilmente iscriverà esclusivamente pazienti con fase di fibrosi 2 e 3”, ha detto Hsieh.
I dati hanno mostrato che VK2809 è rimasto sicuro e la frequenza degli eventi avversi di interesse e il tasso di interruzione erano paragonabili al placebo, ha detto Hsieh. Non ci sono state segnalazioni di epatossicità o malattia della cistifellea, che sono comuni con MASH.
“Nel complesso, crediamo che la nostra tesi secondo cui VK2809 è il miglior farmaco MASH della categoria all’interno della modalità orale sia affermata”, si legge nella nota.
William Blair ha l’equivalente di un rating di acquisto sul titolo, così come tutti i 13 analisti che offrono copertura del titolo su FactSet. La banca è una di molte che si aspettano che Viking sia un obiettivo di acquisizione, data la posizione unica della sua pipeline attraverso lo spettro delle malattie metaboliche.
La pillola per l’obesità dell’azienda VK2735 è pronta per lo studio di fase 3 e l’azienda sta pianificando un programma di amylin che inizierà con uno studio di fase 1 l’anno prossimo. L’amilina è un ormone che aiuta a regolare la glicemia nel corpo.
“Mentre riconosciamo che è rischioso basare la nostra tesi di investimento su un eventuale takeout, la prospettiva è ragionevolmente alta data la differenziazione clinica di Viking, combinata con il grande TAM (mercato totale indirizzabile) delle condizioni metaboliche croniche”, ha detto Hsieh.
William Blair non è il solo a prevedere che la grande farmaceutica acquisirà Viking. Gli analisti di Raymond James hanno scritto molto all’inizio di quest’anno quando hanno detto di considerare VK2735 come migliore del tirzepatide, che è il nome medico del Mounjaro di Eli Lilly
Questo è stato dopo un precedente set di dati e non ha incluso le dosi più elevate nello studio.
Gli analisti di Maxim hanno anche detto che Viking avrà bisogno di un partner per la commercializzazione e anche per lo sviluppo in fase avanzata.
“Considerando la natura competitiva del prodotto e il mercato in crescita di blockbuster, riteniamo che questo aumenti ulteriormente l’attrattiva di Viking come potenziale obiettivo di acquisizione con il programma NASH di Viking al rialzo”, hanno scritto all’epoca.
L’ultimo aggiornamento di Viking sulla sua pillola per l’obesità è stato all’inizio di novembre alla Obesity Week, un evento organizzato dalla Obesity Society. La società ha detto che gli adulti obesi che prendono la dose più alta in uno studio di fase 1 di 100 milligrammi hanno avuto una perdita di peso media dell’8,2% rispetto al basale per un periodo di quattro settimane. La dose da 100 mg ha anche prodotto una perdita di peso fino al 6,8% rispetto al placebo.
24/10/24 Barron’s: Questa Azione Biotecnologica potrebbe salire dell’800%, dice l’analista

Può essere difficile stupire gli analisti, specialmente quelli che sono nel settore da molto tempo. Tuttavia, un analista ha detto a Barron che “raramente nei miei 20 anni come analista ho visto un’azienda con così tanto potenziale”. Stava parlando dell’azienda biotecnologica ImmunityBio IBRX
L’analista di EF Hutton Jason Kolbert ha avviato la copertura delle azioni ImmunityBio con un rating di acquisto e un obiettivo di prezzo di 30 dollari mercoledì. Ciò implica un sorprendente rialzo del 767% al suo attuale prezzo delle azioni di 3,46 dollari.
ImmunityBio è una biotecnologia clinica in fase avanzata con sede a San Diego, in California, pronta a rivoluzionare l’immunoterapia del cancro, secondo Kolbert.
Il prodotto principale dell’azienda Anktiva funziona attivando il sistema immunitario naturale del corpo per eliminare le cellule tumorali e fornire una memoria immunitaria a lungo termine contro il cancro. È stato approvato dalla Food and Drug Administration nell’aprile di quest’anno per i pazienti adulti con cancro che non rispondono all’immunoterapia endovenosa più comune (BCG), cancro della vescica invasivo non muscolare.
La capacità di Anktiva di convertire i tumori freddi in quelli caldi, rendendoli più reattivi all’attacco immunitario, è particolarmente efficace poiché i tumori freddi in genere eludono il rilevamento, ha osservato Kolbert. Questo può potenzialmente migliorare i risultati in vari tumori, compresi quelli tradizionalmente trattati con inibitori del checkpoint, come il melanoma, il polmone, l’ovaio e il colon-retto, rendendoli più vulnerabili a un attacco del sistema immunitario, ha aggiunto.
La società small-cap ha un valore di mercato di 2,8 miliardi di dollari e deve ancora riportare un profitto trimestrale dalla sua quotazione al Nasdaq nel marzo 2021, il che non è raro per le biotecnologie start-up.
Il titolo è salito dell’8,7% a 3,76 dollari giovedì. Alla chiusura di mercoledì, il titolo è sceso del 31% per l’anno.
ImmunityBio non è l’unica azienda focalizzata sullo sviluppo di nuovi trattamenti contro il cancro. Un’altra piccola biotecnologia, Summit Therapeutics SMMTha detto a settembre che il suo farmaco antitumorale Ivonescimab ha sovraperformato il principale farmaco antitumorale Keytruda di Merck in un processo testa a testa.
Sia Keytruda che Anktiva sono tipi di immunoterapia e Ivonescimab è un trattamento anticorpale.
30/03/24 Barron’s: Acquista azioni Voyager, dice l’analista. La piccola Biotech potrebbe avere una svolta.
Da Bill Alpert Segui

Voyager Therapeutics ha sicuramente provato la pazienza degli investitori da quando è diventato pubblico otto anni fa. Le azioni dell’azienda biotecnologica sono scese fino a $ 2,50 da un picco di $ 30, poiché i suoi primi programmi per il trattamento delle malattie neurologiche non hanno funzionato.
Gli analisti di Guggenheim Securities hanno avviato la copertura della biotech con sede a Lexington, Massachusetts, con un rating Buy all’inizio di questa settimana. Dicono che le azioni Voyager potrebbero più che raddoppiare se i suoi nuovi approcci per attaccare il morbo di Alzheimer si dimostrano efficaci. Se Voyager ottiene il permesso di iniziare gli studi clinici, l’analista Debjit Chattopadhyay e i suoi colleghi prevedono che il titolo possa salire dal suo recente prezzo di 9,30 dollari a 22 dollari.
Nei primi anni dopo la sua offerta iniziale del 2015, Voyager ha perseguito terapie geniche per i disturbi nervosi del morbo di Parkinson e del morbo di Huntington. Quelli devono ancora dare i loro frutti. Quando gli investitori sono ampiamente disaffezionati delle biotecnologie in fase di sviluppo dopo la pandemia di Covid-19 si è allentata, la capitalizzazione del mercato azionario di Voyager è collassata. Attualmente è valutata a soli 500 milioni di dollari, poco più dei suoi 430 milioni di dollari in contanti.
Ma l’azienda ha perseverato. La sua buona scienza e competenza nella genetica dei disturbi neurologici gli hanno attirato partner come Neurocrine Biosciences e Novartis che hanno contribuito a finanziarlo.
I programmi che entusiasmano di più il team Guggenheim sono i trattamenti per l’Alzheimer che Voyager possiede a titolo definitivo. Il più avanzato è un anticorpo che si rivolge ai filamenti aggrovigliati noti come tau, che soffocano le cellule cerebrali nell’Alzheimer, insieme alle placche amiloidi appiccicose. Voyager prevede di chiedere alla Food and Drug Administration quest’anno il permesso di iniziare le sperimentazioni cliniche del suo anticorpo tau.
Altre aziende hanno trattamenti tau-targeting, tra cui Biogen , AbbVie , e Roche Holding. Ma l’anticorpo di Voyager sembra concentrarsi solo sui tipi di tau che causano problemi. Guggenheim pensa che le scansioni cerebrali nella sperimentazione clinica dimostreranno la superiorità del trattamento Voyager.
A complemento della sua terapia anticorpale, Voyager ha dimostrato negli animali da laboratorio una terapia genica che può mettere a tacere il gene che guida la produzione delle cattive fibrille tau nell’Alzheimer. Biogen e Ionis Pharmaceuticals hanno già mostrato il silenziamento genico tau negli studi sull’uomo in fase iniziale. A Guggenheim piacciono le possibilità di Voyager, dal suo trattamento genetico sarebbe un’iniezione endovenosa una tantum; mentre, il trattamento con Ionis richiede iniezioni croniche e scomode nel liquido cerebrospinale.
Altri programmi Voyager dove Guggenheim vede valore: stanno sviluppando capsule di virus svuotate che trasportano trattamenti genetici attraverso la barriera emato-encefalica e nelle cellule nervose. Altre tecniche di targeting dei nervi sotto inchiesta presso l’azienda potrebbero far entrare le terapie nei nervi senza bisogno del vettore virale.
Le vendite di prodotti sono ancora a diversi anni di distanza, secondo Guggenheim, ma ci saranno pietre miliari scientifiche prima che le vendite inizino a decollare.
26/02/24 Barron’s: La prima IPO di Biotech del 2024 è schizzata in su del 96%. Sta tornando l’interesse?
DaJosh Nathan-KazisSegui

L’interesse degli investitori per le azioni biotecnologiche di nuova emissione è stato moribondo per anni, ma la prima IPO del settore del 2024 suggerisce che potrebbe cambiare.
L’offerta pubblica iniziare dell’azienda focalizzata sul cancro CG Oncology CGON ha ricevuto un’accoglienza sorprendentemente positiva del mercato giovedì. Il suo titolo è aumentato del 96% nel suo primo giorno di trading pubblico, un debutto che Leland Gershell di Oppenheimer ha definito “un successo sotto qualsiasi punto di vista”.
Il sostanziale pop out of the gate del piccolo titolo biotecnologico suggerisce che l’entusiasmo degli investitori per le biotecnologie rimane ed è un forte segno per il settore per l’anno che si apre.
Le biotecnologie hanno certamente spazio da guadagnare: lo SPDR S&P Biotech ETF che tiene traccia delle azioni biotecnologiche più piccole e medie, è ancora in calo di quasi il 50% dal suo punto più alto all’inizio del 2021. Questo nonostante un aumento di oltre il 30% dall’inizio di novembre, guidato da un’ondata di acquisizioni alla fine del 2023 e speranze per un ambiente di interesse-rate migliore.
Finora nel 2024, l’ETF è sceso di circa l’1%: ha visto guadagni all’inizio di gennaio in mezzo a una serie di annunci di accordi all’annuale J.P. Conferenza sugli investimenti sanitari di Morgan, ma è scesa nelle settimane successive.
Anche se un certo entusiasmo è tornato alle azioni biotecnologiche a piccola e media capitalizzazione, il mercato dell’IPO è rimasto debole. I debutti forti come quelli di CG Oncology sono stati all’ordine del giorno nel 2021, quando un enorme eccesso di circa 100 IPO biotecnologiche di qualità mista ha inondato il mercato. Il rubinetto si è chiuso nel 2022, poiché le scarse prestazioni delle biotecnologie appena quotate, oltre all’aumento dei tassi di interesse, hanno minato l’entusiasmo degli investitori.
Questa è stata una cattiva notizia per la pipeline biotecnologica: si basa sulle IPO per raccogliere fondi per le aziende alle prime armi che hanno bisogno di anni per sviluppare trattamenti e farli approvare prima di vedere qualsiasi reddito. Le grandi aziende farmaceutiche, nel frattempo, hanno bisogno di biotecnologie mature da acquisire per mantenere i propri gasdotti innescati.
Ci sono state circa 20 IPO biotecnologiche ciascuna nel 2022 e nel 2023. Alcuni membri della classe 2023 hanno ottenuto buoni risultati, in particolare RayzeBio, che sta sviluppando farmaci antitumorali. È diventato pubblico a 18 dollari a settembre e ora è scambiato a 62,08 dollari. Un’altra nuova biotecnologia, Apogee Therapeutics, ha fatto il suo debutto a 17 dollari l’azione lo scorso luglio ed è ora scambiata a 36,53 dollari
Forse il membro più noto della classe IPO biotecnologica del 2023 è Structure Therapeutics, che sta sviluppando una pillola per la perdita di peso. Le sue ADR (è una società estera) che hanno fatto il loro debutto a 15 dollari nel febbraio 2023 e ora sono scambiate a 42,15 dollari, dopo essere scese bruscamente a dicembre quando la società ha lanciato dati deludenti
Tuttavia, anche altre IPO biotecnologiche del 2023 non sono andate così. Acelyrin, che è diventata pubblica a 18 dollari per azione a maggio nella più grande IPO biotecnologica dell’anno, è scesa a 7.30 dollari. Neumora Therapeutics, che ha fatto un’IPO a 17 dollari per azione a settembre, è ora scambiata a 15,10 dollari.
Per quanto riguarda la prima IPO biotecnologica del 2024, CG Oncology sta sviluppando un trattamento per il cancro alla vescica progettato per colpire le cellule tumorali e per stimolare il sistema immunitario ad attaccare i tumori del cancro.
La società ha emesso 20 milioni di azioni delle sue azioni ordinarie a un prezzo IPO di 19 dollari giovedì, rispetto a un prezzo precedentemente annunciato tra 16 e 18 dollari per azione. Quando il mercato ha chiuso giovedì, le azioni erano scambiate a 37,17 dollari, per un aumento del 95,6%. Il titolo è sceso leggermente a 34,60 dollari nel trading di venerdì mattina.
CG Oncology ha detto giovedì che avrebbe raccolto 380 milioni di dollari attraverso l’offerta pubblica. Ma Gershell di Oppenheimer prevede che la società probabilmente raccoglierà 437 milioni di dollari, contando le azioni aggiuntive che i sottoscrittori dell’offerta hanno la possibilità di vendere nel prossimo mese.
28/12/23 Forbes: Editing genetico, farmaci per l’obesità e cani a lunga vita: l’anno in biotecnologia
Il 2023 ha visto grandi cambiamenti nella macroeconomia del settore biotecnologico, ma anche importanti pietre miliari tecnologiche per una vita più lunga e più sana.
Alex Knapp Sono un redattore senior di Forbes che si occupa di assistenza sanitaria e scienza.

Come molti settori, l’industria biofarmaceutica ha dato il via a un anno tumultuoso con una serie di scosse. Le grandi e le piccole aziende biotecnologiche hanno visto migliaia di licenziamenti, per non parlare di significativi cambiamenti di leadership.
Nel panorama delle startup, un grande cambiamento è stato un cambiamento strategico tra gli investitori. Secondo un recente rapporto di Pitchbook, quest’anno vedrà solo circa 840 accordi per un totale di circa 24 miliardi di dollari, un grave calo rispetto al 2021, che ha visto oltre 1.500 accordi per un totale di quasi 60 miliardi di dollari. Un grande driver del declino dell’accordo? Il rapporto indica il crollo della Silicon Valley Bank nella primavera di quest’anno, che ha portato “a sfide di finanziamento e a una maggiore cautela negli investimenti”.
Il rapporto rileva anche un “cambiamento strategico” nei tipi di accordi visti nel 2023, “con una tendenza verso meno ma più significativi accordi”. Per i venture capitalist che cercano di fare investimenti, il rapporto rileva una maggiore attenzione alle startup fondate su buoni risultati clinici, nonché alle aziende biotecnologiche che si dedicano allo sviluppo di piattaforme che potrebbero contribuire alla creazione di più farmaci, rispetto alle biotecnologie focalizzate su una o due terapie.
Ma il 2023 ha anche visto una serie di progressi tecnologici che hanno raggiunto alcune importanti pietre miliari, per non parlare di alcuni grandi cambiamenti nel modo in cui gli investitori si stanno avvicinando al settore. “Ci sarà molto da costruire quest’anno”, Vijay Pande, un socio generale di Andreessen Horowitz aveva previsto a Forbes a gennaio – e non si sbagliava.
Ecco quattro dei momenti e delle tendenze che hanno definito l’anno che hanno plasmato la biotecnologia nel 2023 e continueranno a farlo nei prossimi anni.
La FDA approva la prima terapia genica Crispr
Nel gennaio 2013, furono pubblicati i primi articoli seminali che descrivono l’uso delle sequenze del genoma batterico per l’editing genico – chiamati “ripetizioni brevi palindromiche regolarmente intervallate” o “Crispr” in breve. Questi documenti di ricerca hanno evidenziato la capacità di utilizzare questi strumenti batterici per semplificare il processo di correzione delle malattie genetiche. Poco più di un decennio dopo, nel dicembre 2023, quella promessa è stata realizzata quando la prima terapia genica che utilizza gli strumenti Crispr è stata approvata dalla FDA.
Il farmaco è stato co-sviluppato da Vertex Pharmaceuticals e Crispr Therapeutics, una startup co-fondata da Emmanuelle Charpentier, co-vincitrice del premio Nobel per le sue scoperte Crispr. Chiamata Casvegy, la terapia tratta i pazienti con anemia falciforme rimuovendo prima una parte delle loro cellule del midollo osseo, modificando i geni all’interno di quelle cellule, quindi trapiantandoli di nuovo nei pazienti. I dati presentati da Vertex pochi giorni dopo l’approvazione del farmaco hanno mostrato che i cambiamenti genetici sono ancora presenti quattro anni dopo il trattamento dei pazienti.
Questo è solo l’inizio per potenziali terapie genetiche che utilizzano la tecnologia Crispr. Ci sono già dozzine di farmaci in cantiere clinico. Da quando Crispr è stato scoperto per la prima volta, gli scienziati hanno anche sviluppato strumenti di nuova generazione con la tecnologia che consentono un editing genico più preciso e aprono la porta per modificare i geni all’interno del corpo di un paziente. Negli ultimi anni sono state lanciate diverse aziende biotecnologiche che utilizzano queste tecnologie e anche i primi farmaci sviluppati utilizzando strumenti di nuova generazione sono entrati in studi clinici.
I GLP-1 hanno colpito alla grande
I farmaci GLP-1 Ozempic, Wegovy e Monjourno sono in circolazione da un paio d’anni, ma il 2023 è stato l’anno in cui sono davvero scoppiati. I farmaci, che producono miglioramenti significativi per i pazienti con diabete e obesità con pochi effetti collaterali, sono diventati enormi fattori di entrate per la società danese Novo Nordisk e la società farmaceutica Lilly con sede in Indiana. Nel suo più recente rapporto sugli utili, Novo Nordisk ha visto le vendite di Ozempic (per il diabete) e Wegovy (per l’obesità) aumentare del 36% nei primi nove mesi del 2023, raggiungendo un totale di quasi 23 miliardi di dollari nonostante abbia avuto gravi carenze a causa di colli di bottiglia della produzione.
Anche Mounjaro di Lilly è stato un successo per l’azienda, con le sue vendite di quasi 3 miliardi di dollari nel 2023 che hanno contribuito alla crescita dei ricavi dell’azienda del 37% su base annua nel suo ultimo rapporto trimestrale sugli utili. Gli investitori hanno premiato la società con una crescita di quasi il 60% del prezzo delle sue azioni dall’inizio dell’anno. E vengono ricompensati a loro volta, poiché Lilly ha appena approvato un aumento del dividendo del 15% all’inizio di questo mese. È probabile che la tendenza continui da quando la FDA ha recentemente approvato il farmaco di Lilly come trattamento per l’obesità, che ora commercializza con il nome di Zepbound.
Altre aziende stanno lavorando con impazienza per entrare nel gioco GLP-1, come Roche, che all’inizio di questo mese ha annunciato l’acquisizione di Carmot Therapeutics. Quell’accordo, potenzialmente del valore fino a 3,1 miliardi di dollari, darà a Roche tre potenziali farmaci GLP-1 per il diabete e l’obesità attualmente in studi clinici. Nonostante il vantaggio di Lilly e Novo Nordisk, c’è ancora molta quota di mercato da avere nello spazio: un rapporto pubblicato questo mese da Goldman Sachs stima che ci siano oltre 100 milioni di adulti negli Stati Uniti che hanno condizioni che potrebbero potenzialmente essere trattate con farmaci GLP-1. Lo stesso rapporto suggerisce che alla fine è possibile che questi farmaci generino 400 miliardi di dollari di entrate all’anno solo negli Stati Uniti.
Il Sequenziamento Dell’intero Genoma Entra Nella Clinica
Da quando il Progetto del Genoma Umano è stato completato nel 2003, ci sono stati progressi significativi nel sequenziamento del genoma, rendendolo migliore, più veloce e più utile. Per ottenere la velocità richiesta per applicazioni come la diagnostica, i sequencer tagliavano il DNA in minuscoli pezzi in modo che potessero essere rapidamente “letti” e messi in ordine. Ciò ha prodotto potenti progressi, ma ha limitato la quantità di informazioni che i ricercatori e i medici potevano ottenere sui geni di una persona.
Questo è recentemente cambiato con l’avvento del cosiddetto sequenziamento “intero genoma”, che consente di tagliare il DNA in pezzi più grandi in modi che rendono più facile per le macchine di sequenziamento rimetterli insieme nel giusto ordine. Questa tecnologia consente una comprensione della struttura del DNA di una persona, che fornisce una migliore comprensione di come quei geni funzionano effettivamente nel corpo di una persona.
Nel 2023, il sequenziamento dell’intero genoma ha fatto alcuni passi avanti nei laboratori di ricerca e nelle applicazioni di salute pubblica e nella pratica clinica effettiva. All’inizio di questo mese, Orchid, una startup sostenuta dalla cofondatrice di 23andMe Anne Wojcicki e dal CEO di Coinbase Brian Armstrong, ha annunciato che il suo intero sequenziamento del genoma degli embrioni è ora disponibile nelle cliniche di fecondazione in vitro. Questi rapporti consentono ai futuri genitori di esaminare gli embrioni per i rischi genetici e migliorare la possibilità di avere una gravidanza vitale.
E a ottobre, il Children’s Mercy Hospital di Kansas City- ha annunciato che stava mettendo in pratica clinica i suoi interi sequencer del genoma, prodotti da PacBio. Ciò consentirà all’ospedale di accelerare la sua capacità di diagnosticare malattie genetiche nei suoi pazienti, ha detto a Forbes Tomi Pastinen, direttore della medicina genomica dell’ospedale. Ha aggiunto che spera anche che la decisione del suo ospedale ispiri altri a fare lo stesso. “Speriamo che l’adozione clinica sia il catalizzatore per aprire davvero le porte per questi tipi di sequenziamento del genoma”, ha aggiunto.
Una startup trova un modo promettente per vivere più a lungo (se sei un cane)
Non mancano libri, integratori e podcast che promettono il segreto per aggiungere anni sani alla tua vita, ma nonostante l’hype non ci sono ancora farmaci approvati per prolungare la durata della vita umana o di qualsiasi altro animale, se è per questo. È qui che entra in gioco Celine Halioua. La sua azienda, Loyal, sta sviluppando farmaci che potrebbero potenzialmente aiutare i cani a vivere più a lungo, con l’obiettivo di forse un giorno fare lo stesso per le persone.
In primavera, la FDA ha approvato i primi studi clinici della sua azienda per LOY-001, un farmaco che mira ad aiutare i cani grandi e più anziani a vivere più a lungo riducendo le quantità dell’ormone che ha dato loro le loro dimensioni. Poi, in autunno, i suoi studi preliminari hanno ottenuto a Loyal un pollice in su normativo chiave dalla FDA, con le prove fornite sufficienti a sostenere l’idea che il suo farmaco sarebbe stato ragionevolmente efficace nel prolungare la vita di un cane più grande.
L’azienda prevede di spendere l’anno prossimo per ottenere il resto delle approvazioni normative di cui ha bisogno dalla FDA per portare il farmaco sul mercato. Successivamente, la visione è “prendere ciò che abbiamo imparato dai cani e tradurlo in medicina preventiva per le malattie legate all’età nelle persone”, ha detto Halioua a Forbes
08/12/23 Barron’s: La FDA approva le prime due terapie genetiche per l’anemia falciforme, ma le azioni di Bluebird Bio crollano.

La Food and Drug Administration venerdì ha approvato due terapie genetiche per il trattamento di pazienti con anemia falciforme, una grave malattia genetica del sangue più comune negli afroamericani negli Stati Uniti.
I nuovi trattamenti, uno sviluppato da Vertex Pharmaceuticals e Crispr Therapeutics e l’altro di bluebird bio, sono le prime due terapie geniche disponibili negli Stati Uniti per l’anemia falciforme, che secondo la FDA colpisce 100.000 persone negli Stati Uniti.
A metà pomeriggio, le azioni di bluebird erano diminuite del 33,9%. Nasdaq ha interrotto la negoziazione a causa della volatilità quattro volte tra le 13:30 e le 13:55.
L’etichetta della FDA per il farmaco di Bluebird includeva un avvertimento che alcuni pazienti che hanno ricevuto il trattamento avevano sviluppato un cancro al sangue. L’etichetta per il farmaco Vertex e Crispr non includeva tale avvertimento.
Su richiesta di giornalisti, i funzionari della FDA hanno detto che non era chiaro se i tumori osservati nei pazienti nello studio Bluebird fossero a causa del trattamento o a causa del regime chemioterapico che i pazienti devono sottoporsi quando ricevono il trattamento.
“Continueremo a guardare entrambi”, ha detto il dott. Peter Marks, direttore del Center for Biologics Evaluation and Research, alla chiamata. “Quello che possiamo fare solo a questo punto è mettere sull’etichetta ciò che abbiamo visto”.
In una nota nel pomeriggio, l’analista di RBC Capital Markets Luca Issi ha detto di vedere una “battaglia commerciale in salita” per Bluebird e che i medici sceglieranno il trattamento Vertex e Crispr perché non ha un avvertimento simile sulla sua etichetta.
In una battuta d’arresto finanziaria correlata, bluebird ha detto venerdì che la FDA non aveva assegnato all’azienda un buono di revisione prioritaria insieme all’approvazione della sua terapia genica. Tali voucher danno diritto a un’azienda a una revisione normativa più rapida di un farmaco e vengono assegnati dall’agenzia insieme a determinate approvazioni. Bluebird aveva già accettato per vendere qualsiasi voucher di revisione prioritaria che ha ricevuto insieme all’approvazione della terapia genica a Novartis per 103 milioni di dollari; quella vendita non avverrà ora.
La terapia genica Vertex e Crispr, che sarà commercializzata con il nome di Casgevy, è anche il primo farmaco approvato dalla FDA che utilizza una tecnologia di editing del genoma all’avanguardia chiamata Crispr/Cas9. Quella tecnologia, descritta come “forbici genetiche”, ha vinto un premio Nobel per la chimica nel 2020, ma era stata fuori dalla portata dei pazienti di cui poteva beneficiare.
I regolatori del Regno Unito hanno approvato Casgevy a metà novembre.L’approvazione della terapia genica biologica bluebird, Lyfgenia, è stata una sorpresa; una decisione della FDA sul trattamento non era prevista fino al 20 dicembre.
Le azioni Vertex sono scesi dello 0,7% a mezzogiorno di venerdì, mentre le azioni Crispr sono scesi dell’8,7%.
I farmaci potrebbero essere trasformativi per i pazienti in grado di accedervi. I trattamenti falciforme esistenti sono complessi e impegnativi. Sia Casgevy che Lyfgenia offrono la possibilità di una cura una tantum, anche se il processo di ricezione dei trattamenti è arduo.
Bluebird ha detto che avrebbe un prezzo di Lyfgenia a 3,1 milioni di dollari. Vertex, in un documento depositao presso la Sec, ha detto che avrebbe un prezzo di Casgevy a 2,2 milioni di dollari. Le terapie geniche hanno spesso un prezzo di milioni di dollari secondo la teoria che il trattamento può ovviare alla necessità di più trattamenti costosi nel corso della vita. Una terapia genica Bluebird per la beta talassemia chiamata Zynteglo aveva un prezzo di listino di 2,8 milioni di dollari al suo lancio. La società ha detto il mese scorso che 16 pazienti avevano iniziato il processo di ricezione di Zynteglo.
Sia Casgevy che Lyfgenia sono realizzati con le cellule staminali del sangue di un paziente, che devono essere rimosse e poi modificate. Casgevy modifica il DNA delle cellule staminali del paziente, che vengono poi restituite al paziente, dove migliorano la produzione del corpo di una particolare forma di emoglobina. Lyfgenia modifica le cellule staminali utilizzando un approccio vettoriale virale. Per entrambi i trattamenti, il processo per i pazienti è intensivo e richiede lunghe degenze ospedaliere e chemioterapia.
La FDA ha affermato di aver incluso un cosiddetto avviso di scatola nera nella sua etichetta per Lyfgenia, osservando che i pazienti che hanno ricevuto Lyfgenia avevano sviluppato un cancro del sangue e affermando che i pazienti che ricevono Lyfgenia dovrebbero essere monitorati per i tumori del sangue.
31/10/23 Barron’s: La FDA esamina il trattamento di modifica genica Crispr per l’anemia falciforme
DiBill AlpertRistampe

La FDA sta tenendo audizioni su un trattamento per l’anemia falciforme.
Uno dopo l’altro, gli uomini e le donne hanno testimoniato come un nuovo trattamento di editing genetico avesse alleviato la loro sofferenza da anemia falciforme. Hanno affrontato un’udienza di martedì in cui la Food and Drug Administration ha sentito pazienti e scienziati valutare quello che è probabile che sia il primo trattamento genetico approvato dal paese per il disturbo.
L’anemia falciforme ha afflitto le persone di origine africana per generazioni, causando agonia e morte tra coloro che ereditano i suoi globuli rossi deformati. Alla riunione di un giorno, la FDA ha riunito esperti esterni per rivedere il trattamento di editing genetico, prima che l’agenzia prenda una decisione di approvazione.
Sviluppata da Vertex Pharmaceuticals (ticker: VRTX) e Crispr Therapeutics (CRSP), la terapia “exa-cel” sarebbe anche il primo prodotto commercializzato negli Stati Uniti che impiega la tecnologia vincitrice del premio Nobel chiamata Crispr. La tecnica di editing genetico è in grado di prendere di mira un tratto problematico del DNA di una cellula e interrompere il suo guaio. Le aziende hanno concesso in licenza i brevetti delle vincitrici del Nobel Emmanuelle Charpentier e Jennifer Doudna.
Tutti tranne uno delle dozzine di pazienti trattati con exa-cel negli studi clinici sono andati per più di un anno senza le crisi di intasamento del sangue dell’anemia falciforme, e sono stati risparmiati dai frequenti degenze ospedalieri che quelle crisi provocano. L’unica eccezione era un paziente la cui condizione era aggravata da un’infezione e i suoi sintomi erano relativamente lievi.
Le aziende farmaceutiche chiedono l’approvazione della FDA per commercializzare exa-cel per le persone di età superiore ai 12 anni che hanno subito ripetute crisi falciforme. Ci sono circa 20.000 americani con una malattia così grave, tra i 100.000 malati totali di falciforme. In media, qualcuno con anemia falciforme gravi muore a metà degli anni ’40.
Nashville, TN, l’ematologo Haydar Frangoul ha parlato dei suoi pazienti che ora vivono una vita normale, grazie a exa-cel. Prima che apparisse la terapia di modifica del gene, Frangoul poteva curare le cellule falci da anemia solo con un trapianto di midollo osseo. Un donatore corrispondente è disponibile solo per il 15% al 20% dei pazienti, ha detto, e quei pazienti fortunati devono ancora assumere farmaci immunosoppressi per il resto della loro vita.
Documenti della FDA pubblicati online in preparazione per l’incontro non rivelare grandi preoccupazioni all’agenzia per exa-cel. Dopo averli letti la scorsa settimana, l’analista di William Blair Sami Corwin ha scritto che hanno creato “un quasi-best-scenario” per l’incontro e per l’approvazione di exa-cel come trattamento per l’anemia falciforme.
Corwin si era chiesto se l’agenzia potesse avere dubbi sulla sicurezza e l’efficacia della terapia Crispr. Non sembra.
“Dati i risultati fortemente positivi”, afferma il documento di revisione dell’agenzia, “la FDA non crede che le limitazioni della progettazione dello studio mettano in discussione l’efficacia dell’exa-cel”. La FDA non ha nemmeno programmato un voto da parte del comitato consultivo sul fatto che il trattamento si sia dimostrato efficace.
Alla riunione, i revisori dell’agenzia si sono preoccupati principalmente dei test degli sviluppatori exa-cel per le modifiche al DNA off-target che potrebbero causare effetti collaterali.
Il primo testimone esperto della giornata è stato Fyodor Urnov, professore dell’Università della California, Berkeley e pioniere dell’editing genetico (consulte per Vertex). Urnov ha affermato che le tecniche di laboratorio per prevedere e rilevare le modifiche off-target sono notevolmente migliorate nell’ultimo decennio. Ma quei test da banco si stanno avvicinando ai loro limiti, ha detto, quindi ulteriori conoscenze verranno dal trattamento effettivo dei pazienti.
“La tecnologia è pronta per la prima serata”, ha detto Urnov.
Dan Bauer, il direttore della terapia genica al Boston Children’s Hospital, ha detto alla FDA che gli effetti off-target potrebbero essere monitorati con relativa facilità in un disturbo del sangue come l’anemia falciforme.
Ci sono farmaci sul mercato che offrono sollievo a molti dei 100.000 americani che si stima soffrano di falciforme. Ma i pazienti sono comprensibilmente desiderosi di trattamenti che potrebbero essere una soluzione una tantum per il loro disturbo genetico. Accoglieranno con favore l’approvazione di exa-cel e per qualsiasi tra la folla di altri trattamenti genetici per l’anemia falciforme in linea dietro il candidato Vertex/Crispr.
Quel campo affollato è uno dei motivi per cui le azioni di Vertex e Crispr Therapeutics non ho ricevuto molto sollievo dall’avvicinarsi dell’approvazione di exa-cel. Vertex ha approssimativamente tracciato l’Indice NASDAQ , mentre Crispr è rimasto indietro rispetto a entrambi.
Altre ragioni per la diffidenza del mercato azionario sono la complessità del trattamento exa-cel, che lo limita ai centri di trapianto, e il suo prezzo elevato previsto, che potrebbe superare 1 milione di dollari e diventare una vendita difficile per i programmi Medicaid che coprono molti pazienti con anemia falciforme.
L’analista di RBC Luca Issi ha quindi scritto la scorsa settimana che l’assorbimento di una terapia exa-cel approvata potrebbe essere lento. Si aspetta che exa-cel im vorranno molto tempo per aumentare in modo significativo le entrate di Crispr Therapeutics e Vertex o delle loro azioni.
Tuttavia, il trattamento di modifica del gene sarà il primo di molti. I miglioramenti già in fase di studio a Crispr e altrove potrebbero produrre soluzioni più economiche e meno complesse per mali genetici come l’anemia falciforme.
25/10/23 Barron’s: Queste azioni di editing dei geni sono sopravvissute. Dagli un’altra occhiata.
DiBill AlpertSegui
2Ristampe

Il cosiddetto editing di base è meno dirompente per le cellule rispetto alla maggior parte delle tecniche di editing genetico.
Il mercato ha quasi abbandonato molte delle start-up biotecnologiche che ha finanziato nell’eccitazione dei primi vaccini Covid nel 2021, lasciando i pionieri di un approccio elegante all’editing dei geni noto come base-editing nella pila de vestiti fuori moda.
Gli investitori non dovrebbero cancellarli.
Beam Therapeutics (ticker: BEAM), è stato il primo a ottenere i diritti sulla tecnologia, una variante meno dirompente dell’approccio di editing genetico Crispr vincitore del premio Nobel. la sua azione si è avvicinata a 140 dollari nel giugno 2021 in quanto ha preso di mira il cancro e l’anemia falciforme. Verve Therapeutics (VERV) tecnologia Beam autorizzata per prevenire le malattie cardiovascolari e ila sua azione una volta ha superato i 76 dollari.
Ora Beam va per 20 dollari e Verve per 9,50 dollari. Aggiungilo all’impazienza del mercato con le biotecnologie che bruciano denaro che devono ancora commercializzare un prodotto.
Gli investitori dovrebbero essere consapevoli che ogni notizia annunciata di recente, volta a garantire agli investitori che i loro programmi clinici andranno avanti. Beam ha detto la scorsa settimana che sta concentrando le sue risorse su alcuni programmi e taglierà il personale. Verve ha detto lunedì che la Food and Drug Administration ha concesso il via libera alle sperimentazioni statunitensi del suo trattamento.
La maggior parte delle tecniche di editing genico può azzerare un tratto fastidioso del nostro DNA e eliminarlo tagliando i doppi filamenti della molecola. Questo è il metodo testato negli studi clinici dai pionieri di Crispr come Intellia Therapeutics (NTLA), Crispr Therapeutics (CRSP) e Editas Medicine (EDIT) in quanto disabilitano i geni difettosi che causano l’anemia falciforme e altre malattie ereditarie.
La modifica di base fa una modifica più delicata al DNA. Nicks solo uno dei due filamenti del DNA e cambia una singola lettera di codice genetico, conosciuta in laboratorio come “base”, in un modo che è meno dirompente per le nostre cellule.
Con fondi provenienti da un’offerta pubblica iniziale e da partnership con aziende del calibro di Pfizer (PFE), Beam aveva una pipeline di programmi mirati a mali che andavevano dal cancro all’epatite. Ma con il traguardo della sua prima approvazione non prima di un paio d’anni – e il mercato meno desideroso di offerte di azioni secondarie biotecnologiche – Beam ha detto il 19 ottobre che avrebbe disattivato il 20% della sua forza lavoro e congelato programmi come il suo trattamento dell’epatite.
Beam ha detto che il winnowing lascerà abbastanza denaro per durare fino al 2026. La società aveva 1,1 miliardi di dollari in bilancio a giugno. L’analista di William Blair Sami Corwin si aspetta che Beam riporti una perdita di circa 350 milioni di dollari quest’anno, o 4,447 dollari per azione.
L’azienda ha dosato i primi pazienti con una correzione base-editing per l’anemia falciforme a settembre. Come altri trattamenti genetici per la malattia del sangue, la riparazione di Beam alle cellule del sangue dei pazienti avrà luogo al di fuori del corpo. I risultati saranno pubblicati nel 2024, insieme alle letture sul primo trattamento di base-editing per una malattia epatica ereditaria chiamata carenza di alfa-1 antitripsina. Blair’s Corwin valuta le azioni su Buy.
Verve ha già iniziato le prove all’estero di base-editing per correggere i difetti genetici che lasciano alcune famiglie con livelli di colesterolo disastrosamente alti. Ma negli Stati Uniti, la FDA ha ritardato l’inizio degli studi clinici mentre cercava maggiori informazioni sulla sicurezza della modifica di base. Quella decisione, divulgata nel novembre 2022, ha affondato l‘azione .
Lunedì, Verve ha detto che la FDA lascerà iniziare la sua sperimentazione negli Stati Uniti. La sua potenziale soluzione una tantum per il colesterolo alto ereditato sarà la prima volta che la FDA consentirà l’editing di base all’interno di un paziente o in vivo.
Le buone notizie di Verve dovrebbero anche rallegrare gli investitori di Beam, ha scritto Corwin lunedì, perché Beam mira a fare modifiche di base in vivo e otterrà una quota delle vendite di Verve.
Un ulteriore sviluppo per Verve è imminente: i ricercatori presenteranno i dati iniziali degli studi clinici internazionali di Verve alla conferenza dell’American Heart Association il 12 novembre. Se il trattamento una tantum riduce il colesterolo in modo efficace come i prodotti commercializzati come Leqvio di Novartis (NVS), Repatha di Amgen (AMGN), o Praluent di RegeneronREGN1.10%, Corwin di Blair pensa che le azioni Verve potrebbero triplicare, a più di 30 dollari. Lo valuta a Buy.
Scrivi a Bill Alpert all’indirizzo william.alpert@barrons.com
18/06/23 Barron’s: Il Gene Editing Sta Funzionando. Wall Street Sta Prendendo Nota.
Di Bill AlpertFollow

Le azioni di editing genetico stanno riguadagnando il favore a Wall Street quest’anno mentre si accumulano evidenze positive per i loro trattamenti di malattie mortali come l’anemia falciforme.
Azioni di Crispr Therapeutics (ticker: CRSP) sono in aumento del 45% quest’anno, rispetto alNasdaq Composite è un aumento del 31%. Una settimana fa, la Food and Drug Administration ha indicato che potrebbe raggiungere una decisione di approvazione intorno alla fine di quest’anno per il loro trattamento dell’anemia falciforme
il Pollice alzato sarebbe la prima approvazione degli Stati Uniti per una terapia basata sulla tecnologia vincitrice del premio Nobel nota come Crispr. Vertex PharmaceuticalsVRTX –0.28% (VRTX) ha collaborato con Crispr Therapeutics sulla falciforme.
Le aziende di editing genetico sono diventate pubbliche per la prima volta sei anni fa. Quando le tecnologie genetiche stavano guidando la lotta contro il Covid nel 2021, Wall Street non ne aveva mai abbastanza di qualsiasi azione che sfruttasse Crispr, una tecnologia che può riscrivere i geni difettosi responsabili di malattie come l’anemia falciforme o il relativo disturbo delle cellule del sangue beta talassemia.
L’azienda con sede a Crispr Intellia Therapeutics (NTLA) ha visto le sue azioni in picchiare da 12 a 177 dollari dal 2020 al 2021 mentre avanzava il suo trattamento per un disturbo debilitante chiamato amiloidosi ATTR. Poi le azioni biotecnologiche sono cadute in disgrazia.
Intellia è sceso dell’80% dal suo picco del 2021. Crispr Therapeutics è sceso da circa 220 dollari all’inizio del 2021 a meno di 40 dollari quando è iniziato quest’anno. Da allora è rianimato, così come Intellia, che è in aumento del 29% quest’anno.
Un fattore di sfavore della medicina genetica a Wall Street potrebbero essere stati i lunghi studi clinici necessari per garantire la sicurezza del nuovo approccio. Ma il traguardo è ora in vista.
Lo scorso fine settimana, i ricercatori hanno detto a una conferenza medica europea che il trattamento falciforme di Crispr Therapeutics e Vertex ha liberato circa il 90% dei pazienti dalle crisi di intasamento delle arterie causate dalla malattia, nei 12 mesi successivi al trattamento una tantum. Una parte comparabile dei pazienti con beta talassemia è stata liberata dalla necessità di trasfusioni in sei mesi di follow-up.
La FDA ha già approvato una terapia genetica per la beta talassemia l’anno scorso da bluebird bio (BLU). Il trattamento Zynteglo dell’azienda utilizza un approccio diverso da Crispr per inserire geni sani nei pazienti con talassemia, con il 90% che raggiunge la libertà dalla trasfusione. I primi sette pazienti hanno iniziato il trattamento da 3 milioni di dollari quest’anno. Bluebird è anche proprio dietro Crispr e Vertex alla ricerca di un’approvazione falciforme.
Negli Stati Uniti, la cellula falciforme colpisce principalmente persone di origine africana subsahariana e le risorse mediche non sono sempre state accessibili a quella comunità. Quindi è gratificante che la malattia genetica stia ora attirando l’attenzione commerciale. Molta attenzione, a quanto pare.
Alla riunione della European Hematology Association della scorsa settimana, insieme all’aggiornamento di Crispr Therapeutics, i ricercatori hanno sentito buoni risultati iniziali da un trattamento falciforme testato da un altro sviluppatore di tecnologia Crispr, Editas Medicine (EDIT). Altri redattori di geni che perseguono l’anemia falciforme includono Beam Therapeutics (BEAM).
Quindi potrebbero esserci una folla di trattamenti in competizione per i pazienti con cellule falciformi. La domanda potrebbe essere limitata ai pazienti più gravi, all’inizio, perché i trattamenti attuali richiedono una chemioterapia iniziale per spazzare via le cellule del sangue geneticamente difettose prima di innestare le loro sostituzioni geneticamente alterate. Circa la metà dei pazienti sperimenta gravi nausea e febbre durante questo precondizionamento e le donne emergono sterili.
Le aziende di medicina genetica sono alla ricerca di approcci di condizionamento più miti.
Con 100.000 americani che vivono con l’anemia falciforme, l’analista di Raymond James Steven Seedhouse pensa che circa 1.700 pazienti all’anno riceveranno trattamenti genetici entro il 2027. Pensa che ognuna di queste procedure una tantum costerà circa 1 milione di dollari.
Dovrebbero seguire correzioni di editing genetico per altre malattie. Per gli investitori, è stata una lunga attesa.
Scrivi a Bill Alpert all’indirizzo william.alpert@barrons.com
16/06/23 Ark-Invest: editing genetico
ARK Invest> Articoli > Ricerca degli analisti > Genetic Editing: un primer
Una lunga analisi che ho tradotto e che spiega bene la frontiera della medicina genetica

Di: Alexandra Urman, Andrew Kim
Nel 1953, la scoperta della struttura e della funzione del DNA galvanizzò l’innovazione nella genetica: lo studio dei geni, della variazione genetica e dell’ereditarietà. Tuttavia, molti concetti fondamentali in genetica, sequenziamento genico e editing genico sono stati difficili da cogliere, fino a poco tempo fa (Pray 2008).
Nella speranza di curare la malattia, Emmanuelle Charpentier e Jennifer Doudna hanno sviluppato un metodo rivoluzionario di editing genetico chiamato CRISPR/Cas9 e hanno vinto il premio Nobel per la chimica nel 2020 (NobelPrize.org 2020). Data la diffusa curiosità su CRISPR/Cas9, il suo meccanismo e le sue applicazioni, questo Primer offre ai lettori una panoramica dell’editing genetico.
Dopo una breve storia di revisione dei concetti fondamentali, approfondiremo le diverse tecniche di editing genetico.
Panoramica storica[1]
Durante la metà del XIX secolo, Charles Darwin e Alfred Russel Wallace scioccarono il mondo scientifico con l’idea rivoluzionaria che le specie siano un prodotto della selezione naturale e dell’evoluzione. La loro ipotesi implora le domande. Come passano i tratti dai genitori alla prole? Quali processi sono alla base dell’espressione di tratti che spiegano sia la diversità che l’omogeneità?

Gli esperimenti di Gregor Mendel sulle piante di piselli hanno risposto ad alcune domande, in particolare che tratti come l’altezza e il colore delle piante variavano a seconda dei tratti genitori. Un po’ frainteso durante la sua vita, il lavoro di Mendel riacquistò importanza quando il biologo William Bateson coniò il termine “genetica” nello studio dell’ereditarietà (Bateson 1905). Prima del lavoro di Mendel, la maggior parte degli scienziati presumeva che i tratti della prole fossero una media dei tratti dei genitori (Bulmer 1999). Eppure, se così fosse, ogni tratto sarebbe confluita alla sua media dopo più generazioni. In altre parole, la teoria “media” non spiegava la diversità all’interno e tra le specie. Al contrario, le leggi di eredità di Mendel suggerivano che i tratti della prole erano una funzione di contributi discreti, uno di ogni genitore.
Le leggi di Mendel non rispondevano ad altre domande sull’ereditarietà Nel 1869, Friedrich Miescher isolò l’acido nucleico, uno dei principali elementi costitutivi del DNA, ma solo nel 1944, quando Oswald Avery, Colin MacLeod e McCarty manipolarono il contenuto cellulare dei batteri, fecero evolure la prova che il DNA era il deposito Anche prima di scoprire il ruolo del DNA nell’ereditarietà, gli scienziati hanno capito che le cellule si scambiano materiale genetico sia durante la riproduzione somatica (non sessuale) che durante la riproduzione delle cellule sessuali (Cohen 2018).
Identificare il DNA come contenuto ereditario che governa i sistemi biologici è stato il primo passo per comprendere la funzione del codice genetico. Negli anni ’50, James Watson, Francis Crick, Rosalind Franklin e Maurice Wilkins rivelarono il DNA a livello molecolare, consentendo agli scienziati di progredire verso il sequenziamento e l’editing genico.
Le sequenze di DNA codificano per la sintesi di proteine specifiche che governano i processi corporei, una relazione chiamata Dogma Centrale. Il dogma centrale, a sua volta, ha sollevato più domande.

Fonte: ARK Investment Management LLC, 2023.
Come potremmo manipolare le sequenze di DNA per alterare processi o funzioni biologiche?

Concetti fondamentali[3]
Quali sono le molecole fondamentali che governano i sistemi biologici? Questa sezione li illustra in ordine di dimensioni fisiche.
Cellule: Le cellule sono le unità viventi più piccole del nostro corpo (National Cancer Institute 2011). I nostri corpi ospitano cellule viventi altamente specializzate. La pelle e il sangue, per esempio, sono costieri da trilioni di cellule che sono differenziate per svolgere funzioni distinte.
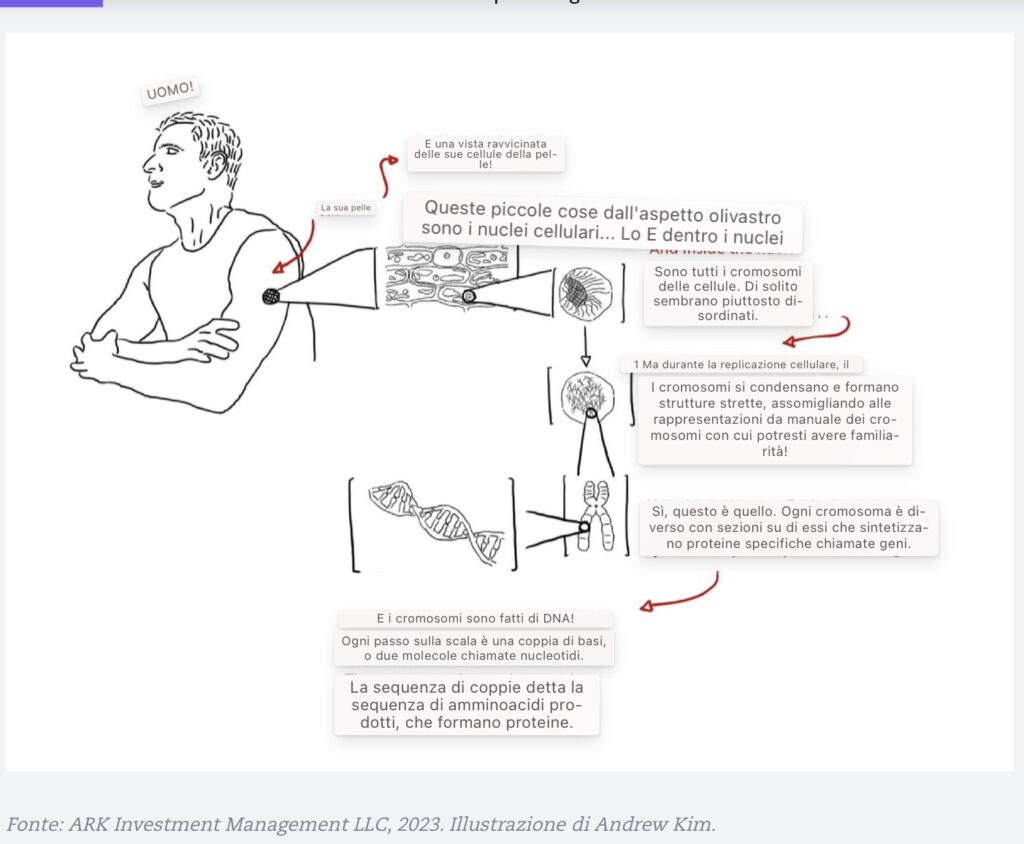
Ognuno dei nostri ~200 tipi di cellule, dalle cellule staminali alle cellule del sangue, alle cellule nervose, alle cellule adipose, ha una struttura in miniatura simile a un organo chiamata nucleo che contiene informazioni ereditarie all’interno dei cromosomi (Baxter 2021).

Cromosomi: Le nostre informazioni ereditarie sono altamente complesse e organizzate in strutture chiamate cromosomi. All’interno del nucleo di ogni cellula umana ci sono 23 coppie di cromosomi, o 46 strutture individuali.[ 4] Il numero di cromosomi varia da specie a specie. I batteri hanno spesso singole molecole di DNA, mentre le fragole possono avere 56 o anche 70 cromosomi totali per cellula (Hummer et al. 2009).

Geni: ogni cromosoma è come un mercato con diversi negozi o sezioni chiamati geni. I geni spesso contengono istruzioni che sintetizzano le proteine, ma alcuni non hanno alcuna utilità. Il genoma è il set completo di geni o informazioni genetiche, ma solo l’1-2% del genoma umano contiene geni che codificano le proteine. In altre parole, ~99% dei “negozi” nel “centro commerciale” sono “non occupati” o non funzionali (Henninger 2012). Gli scienziati stimano che gli esseri umani abbiano ~20.000 geni.

L’attivazione genica è fondamentale per lo sviluppo e il funzionamento di tutti gli organismi viventi, consentendo contemporaneamente diversità e omogeneità. Mentre l’aspetto, la salute e la personalità di un essere umano possono differire significativamente da quelli della sua amica, per esempio, i genomi dei due amici hanno molto più in comune tra loro che con gli elefanti.
Mentre un gene può determinare un tratto – la malattia di Huntington, per esempio (Bhattacharyya 2008) – più geni e l’ambiente determinano la maggior parte dei tratti. Un singolo gene può anche influenzare più tratti (Lobo 2008).
Proteine: in che modo i geni determinano i tratti? Tecnicamente, mantengono le istruzioni che codificano le proteine. Le proteine sono composti organici composti da elementi costitutivi chiamati aminoacidi che svolgono ruoli specifici e vitali nella crescita e nel mantenimento delle nostre cellule (EUFIC 2019).

Rappresentazione della struttura chimica
Le proteine sono la forza lavoro primaria nel corpo umano: controllano la maggior parte delle sue strutture, eseguono reazioni chimiche ed elaborano segnali e informazioni (Ahlgren 2021). Senza di loro, la vita cesserebbe di funzionare.

DNA: Per capire il DNA, i cromosomi sono necessari. I cromosomi costituiscono il DNA e altre molecole che tengono insieme il DNA. I geni sono regioni specifiche che codificano le proteine in base alle istruzioni abilitate al DNA. Il DNA è costituito da due fili collegati in una struttura simile a una scala che, a sua volta, viene attorcigliata in una doppia elica.
Basi del DNA: ogni scaletta della scala del DNA è fatto di due molecole unite da legami idrogeno. Il DNA comprende quattro molecole primarie: adenina, timina, citosina e guanina. L’adenina si accoppia sempre con la timina, e la citosina si accoppia sempre con la guanina. Queste molecole (o “basi”), e l’ordine in cui appaiono, forniscono il codice genetico – le istruzioni – necessarie alle cellule per organizzare vari aminoacidi. Quando vengono uniti, gli amminoacidi costituiscono una proteina specifica. Insieme, alimentano la vita.
Struttura del DNA


RNA: Negli esseri umani, l’RNA è un composto a singolo filamento che invia messaggi tra DNA e aminoacidi (Clancy e Brown 2008). Per capire il processo, considera questa analogia. Immagina un’insegnante che parla solo inglese e tutti i suoi studenti parlano solo spagnolo. L’insegnante di lingua inglese vuole che i suoi studenti allineino un singolo file in ordine alfabetico in base ai loro cognomi. Fortunatamente, la sua amica di lingua spagnola può tradurre la richiesta. In questo esempio, l’insegnante di lingua inglese è analoga al DNA e al suo amico di lingua spagnola, l’RNA, mentre ogni bambino è analogo a un amminoacido, e all’intera linea di bambini, la proteina.
Filo di acido nucleico

Editing genetico: un primer
Qual È Il Potenziale Dell’editing Genetico?
L’editing genetico ha il potenziale per curare una serie di disturbi genetici potenzialmente letali. Prendi l’esempio della fibrosi cistica. Cos’è e in che modo l’editing genetico potrebbe aiutare coloro che ce l’hanno?
1. Iniziamo con una semplice illustrazione. In un punto su un cromosoma specifico nelle cellule, la maggior parte delle persone ha una sequenza di DNA come questa:

2. Quindi identifichiamo una persona con questa sequenza di DNA:

Per la maggior parte delle persone nel nostro ipotetico universo, la sequenza di DNA AAA codifica per un amminoacido specifico chiamato fenilalanina. Per la persona unica, la sequenza del DNA AAT codifica per un amminoacido chiamatoleucina. Con trilioni di cellule che riproducono e sintetizzano continuamente le proteine, questo semplice errore può precipitare in conseguenze devastanti (Drummond e Wilke 2009).
3. Ora, considera che la sequenza di DNA in questione si trova in una regione chiamata gene CFTR, che è responsabile della produzione di una proteina chiamata regolatore di conduttanza transmembrana della fibrosi cistica. Quel regolatore facilita il trasporto di particelle attraverso le pareti delle cellule che producono muco, sudore e altre sostanze biologiche (Winikates 2012). Mentre la sequenza del DNA AAA produce fenilalanina per sintetizzare la proteina CFTR, la sequenza AAT produce leucina, in modo errato, per così dire, perché, senza fenilalanina, il gene CFTR non può produrre correttamente la proteina CFTR, portando alla fibrosi cistica (Canadian Agency for Drugs and Technologies in Health 2018).
4. Sappiamo che qualcosa nel DNA AAA sta dando origine alla fibrosi cistica. E se potessimo prendere di mira la sezione mutante del DNA AAA nel gruppo di cellule, apportare le modifiche richieste, consentire alle cellule di dividersi e sostituire tutte le cellule care di errori con cellule prive di errori? In altre parole, e se potessimo modificare il DNA, in modo che si evolva correttamente invece di creare la fibrosi cistica?
Questo problema semplificato e ipotetico ci prepara ad approfondire le diverse tecniche di gene-editing e alcune delle loro applicazioni.
Cos’è l’editing genetico?
L’ingegneria genetica ha preso piede negli anni ’70 quando Rudolf Jaenisch e Beatrice Mintz iniettarono DNA virale negli embrioni dei topi (Jaenisch e Mintz 1974). Molti scienziati hanno sperimentato ulteriormente, introducendo materiali ereditari stranieri nei soggetti di prova e, negli anni ’80, tre gruppi di scienziati hanno sviluppato un metodo per indirizzare e disattivare specifici geni dei topi (NobelPrize.org 2007).
Il metodo si basava su un processo chiamato ricombinazione omologa, in cui cromosomi simili scambiano sequenze di DNA – o RNA, per virus – l’uno con l’altro, aumentando la variazione genetica nel processo (Masood et al. 2016). Gli scienziati hanno scoperto che un’interazione simile può verificarsi tra il DNA estraneo e i cromosomi delle cellule di mammifero (NobelPrize.org 2007). Il metodo ha dimostrato che era possibile l’eliminazione delle malattie causate da mutazioni nel genoma. Gli scienziati hanno poi iniziato a evolvere modi più efficienti di indirizzare i geni (Woolf 1998).[ 5]
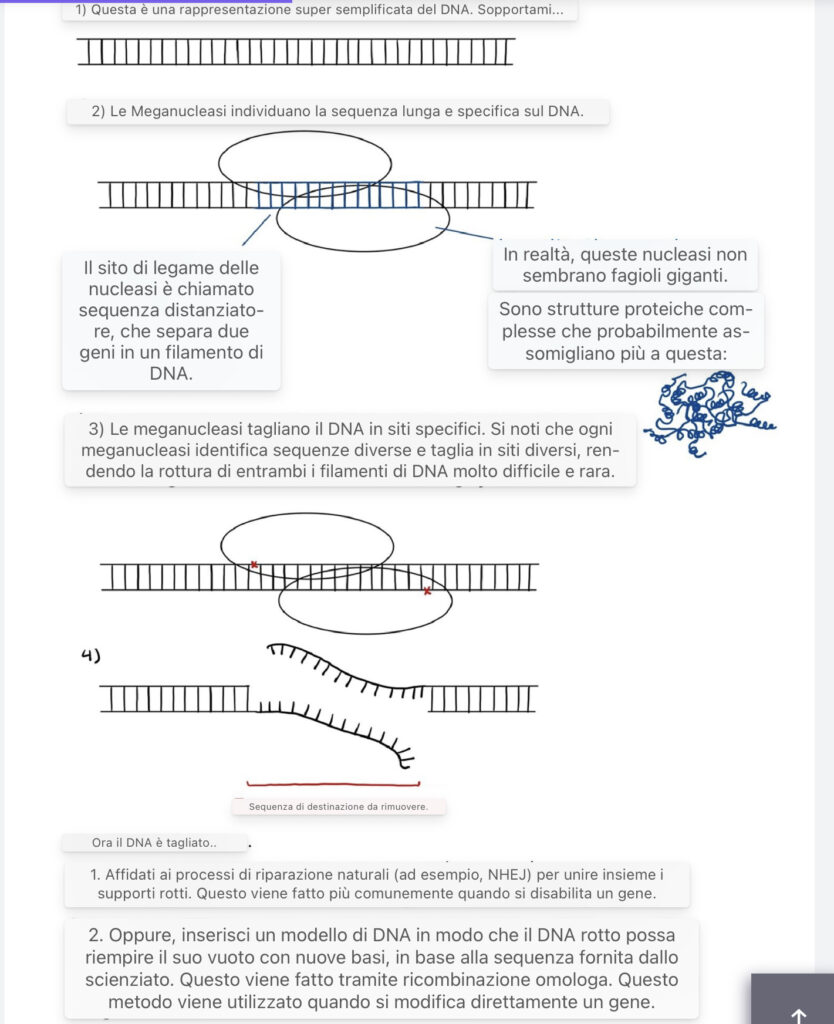
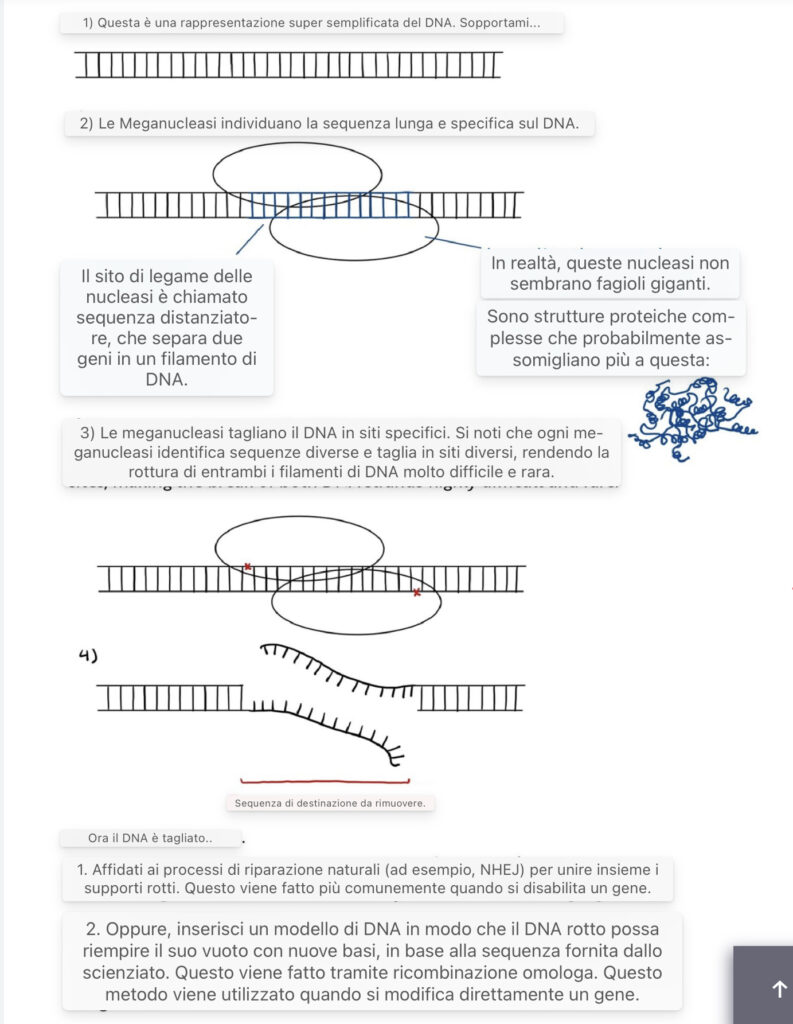
Metodi di modifica genica: Meganucleasi
Le meganucleasi sono enzimi che riconoscono sequenze di DNA che vanno da 12 a 45 coppie di basi e possono tagliare il DNA in siti specifici. Negli anni ’90, gli scienziati hanno scoperto che questi enzimi potrebbero essere importanti per l’ingegneria genetica (Epinat et al. 2003), agendo come “forbici” che creano rotture in posizioni specifiche del DNA per sostituire completamente la sequenza o per inserire nuove basi all’interno della rottura.
Poiché le meganucleasi prendono di mira sequenze di grandi dimensioni, le loro applicazioni sono limitate poiché la possibilità di trovare sequenze grandi e specifiche in un gene è bassa. Di conseguenza, gli scienziati stanno evolvendo ed espandendo la libreria di sequenze che le meganucleasi possono colpire, modificando le sequenze di DNA mirate o creando meganucleasi artificiali (Hoy 2013).
Un’illustrazione dell’ingegneria genetica tramite le megacleasi
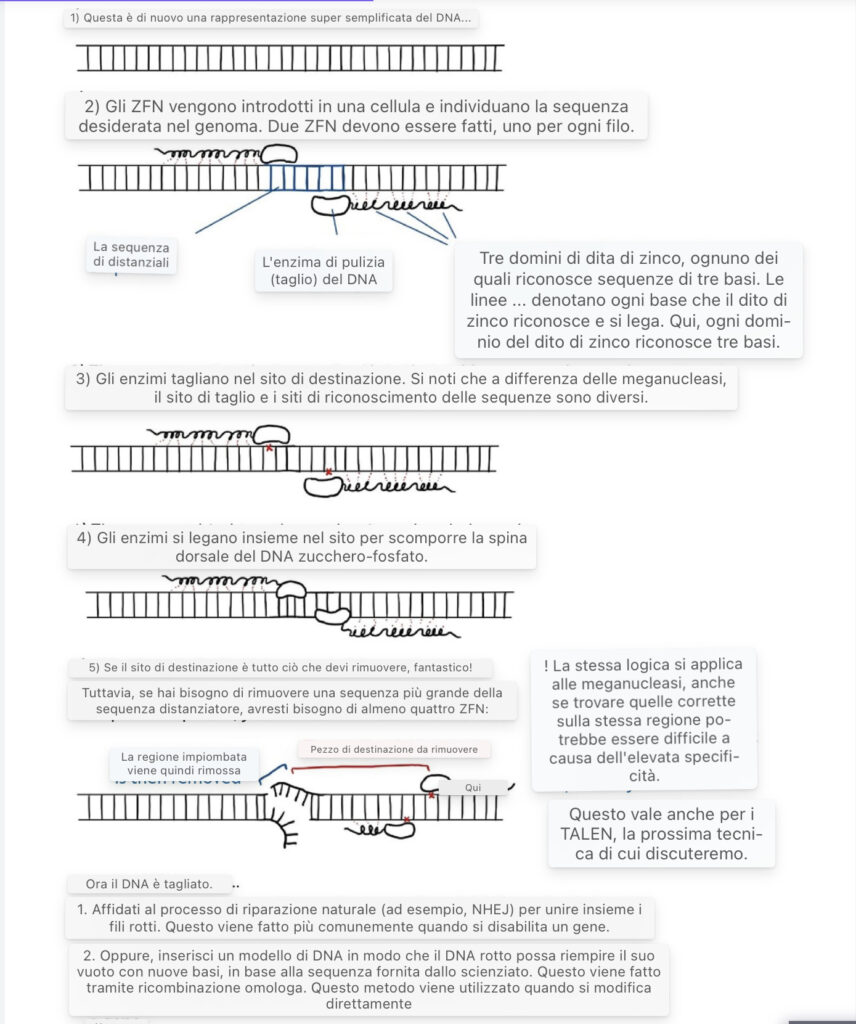
Metodi di modifica genica: Nucleasi delle dita di zinco (ZFN)
Mentre le meganucleasi tagliano il DNA in siti altamente specifici, le nucleosi delle dita di zinco possono colpire fino a 18 coppie di basi specificate dagli scienziati utilizzando strutture simili a Lego chiamate dita di zinco (Martinez-Lage et al. 2017). Le dita di zinco sono strutture proteiche naturali che si legano a diverse sequenze di DNA (Klug 2010).
Ogni dito di zinco può riconoscere sequenze di DNA di tre o quattro coppie di basi e, se combinate, possono identificare e legare a una specifica sequenza di DNA 24 coppie di basi o più lunghe (Kim et al. 2009). In genere, le dita di zinco sono più flessibili delle meganucleasi nelle applicazioni di ingegneria genetica. Combinando le dita di zinco con un enzima che taglia il DNA simile ma meno specifico delle meganucleasi, gli scienziati hanno creato ZFN che prendono di mira e tagliano una vasta gamma di DNA con una precisione senza precedenti.
Detto questo, gli ZFN non sono privi di rischi. Se le dita di zinco non sono abbastanza specifiche per la sequenza di DNA bersaglio, la nucleasi può tagliare il DNA involontariamente in posizioni indesiderate e fuori bersaglio, uccidendo potenzialmente del tutto la cellula (Cornu et al. 2008). Mentre la ricerca di dita di zinco sufficientemente specifiche per la sequenza di DNA mirata è stata difficile, il recente investimento in tecniche avanzate di ingegneria delle dita di zinco sta affrontando questi problemi (Paschon et al. 2019).
Nel 2021, un gruppo di ricercatori della California e dell’Australia ha pubblicato risultati promettenti di uno studio che esplora l’efficacia delle proteine delle dita di zinco nel reprimere l’espressione dell’HIV-1, invece di costringere i pazienti HIV-positivi a sessioni di terapia stressante (Shrivastava et al. 2021). Inoltre, Sangamo Therapeutics, che sta sviluppando tecniche di editing genetico basate su ZFN per il trattamento dell’anemia falciforme, ha rilasciato risultati positivi di fase I/II in tre pazienti sottoposti a terapia cellulare modificata geneticamente per l’anemia falciforme (Philippidis 2021).
Un’illustrazione dell’ingegneria genetica tramite ZFN
Metodi di modifica genica: Nucleasi effettrici simili all’attivatore di trascrizione (TALEN)

Con una differenza chiave, i TALEN sono simili agli ZFN: mentre ogni dito di zinco riconosce più basi, in genere tre, su una sequenza target, ogni proteina Transcription Activator-Like Effector (TALE) riconosce solo una base. Di conseguenza, gli scienziati possono creare strutture che identificano sequenze specifiche nel genoma (Yeadon 2014). Nel 2010, i ricercatori della Iowa State University, hanno sviluppato il metodo di combinazione di proteine TALE con enzimi DNA-cutting e hanno creato un’alternativa più flessibile agli ZFN (Christian et al. 2010).
Fin dalla loro scoperta iniziale, i TALEN sono stati ampiamente utilizzati per modificare i genomi di varie piante. Nel 2014, un gruppo di ricercatori ha usato i TALEN per introdurre mutazioni in due geni nella soia, facendo sì che i loro semi convertessero il grasso mono-insaturo in grasso polinsaturo per una soia più sana per una soia più sana nelle diete umane (Haun et al. 2014). Dalla sua fondazione nel 2010, la società di tecnologia agricola Calyxt ha sfruttato TALENs e attualmente sta sviluppando avena che può crescere nei climi freddi (Calyxt 2021).
Anche i TALEN sono in fase di sviluppo per la consegna negli esseri umani. La società biotecnologica Cellectis, ad esempio, utilizza TALEN per modificare i geni dei globuli bianchi derivati dal donatore (cellule T) e li inserisce in pazienti con leucemia e mieloma multiplo (Cellectis 2021).
Un’illustrazione Di Ingegneria Genetica Con TALEN
Metodi di editing genico: CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) + Cas9 Proteins

A differenza delle tecniche discusse sopra, CRISPR/Cas9 non richiede agli scienziati di dedicare tempo alla costruzione di nuove strutture proteiche per colpire una specifica sequenza di DNA. Piuttosto, possono programmare una chiave di risposta, l’RNA guida singola (sgRNA), per indirizzare una specifica sequenza di DNA. Se combinato con una proteina di taglio del DNA chiamata Cas9, CRISPR/Cas9 consente l’editing genetico più efficiente e flessibile. Mentre CRISPR Cas9 è stato il primo enzima ad essere scoperto e studiato, altri enzimi Cas hanno proprietà diverse.
Le “ripetenze tandem” nel DNA si riferiscono a modelli ripetuti e riconoscibili nelle basi del DNA che sono adiacenti tra loro (National Human Genome Research Institute 2021). Le sequenze “CATCATCATCAT” e “AGAGAGAGAGAG” sono ripetizioni tandem, per esempio. Durante gli anni ’80, gli scienziati hanno scoperto ripetizioni nel genoma dei batteri E. coli che, a differenza della maggior parte delle ripetizioni tandem, erano separate da sequenze di distanziatori o segmenti di DNA che separano due geni attivi l’uno dall’altro (Vidyasagar e Lanse 2021). Queste sequenze sono anche palindromiche, il che significa che la sequenza di una parte della scala è identica alla sequenza sull’altro lato della scala al contrario.

La ricerca su queste misteriose sequenze ripetute ha rivelato (1) che queste “ripetenze” sono presenti in molti altri batteri e archebatteri e (2) che queste sequenze hanno una certa associazione con altri geni che producono proteine che tagliano il DNA (Mojica et al. 2000). Nel 2007, i ricercatori hanno concettualizzato la funzione del CRISPR nei batteri come banca di memoria per precedenti attacchi da virus stranieri (Barrangou et al. 2007). Dopo un attacco virale, i batteri incorporerebbero parti del genoma virale nel proprio DNA come sequenze di distanziatori in modo che, negli attacchi futuri, i batteri potessero dirigere le proteine di scisplicing del DNA (proteine Cas9) – con l’aiuto dell’RNA CRISPR (crRNA) e dell’RNA transattivante (tracrRNA) – a tagliare 2011; Jinek et al. 2012; Vidyasagar e Lanse 2021).
Questi batteri agiscono come giudici federali. La prima volta che il virus commette un crimine, un attacco virale, il giudice e la giuria determineranno se è colpevole o meno. Quindi, se un altro virus con lo stesso RNA commette lo stesso crimine, il giudice ha un precedente, sotto forma di sequenze distanziali CRISPR, per condannare il nuovo virus in modo più efficiente.
Nel 2012, due gruppi di scienziati si sono resi conto che il meccanismo batterico di targeting e taglio del DNA poteva essere utilizzato in altre specie, compresi gli esseri umani, programmando manualmente il crRNA per indirizzare qualsiasi sequenza di DNA desiderata. Rendendo il processo ancora più semplice, le vincitrici del premio Nobel Emmanuelle Charpentier, Jennifer Doudna e i loro colleghi hanno trovato un modo per combinare il crRNA e il tracrRNA in un unico RNA guida (sgRNA) (Gasiunas et al. 2012; Jinek et al. 2012). La scoperta ha permesso a tre gruppi di scienziati nel 2013 di capire i metodi per condurre l’editing genetico CRISPR/Cas9 in-vivo, o nell’organismo vivente (Cong et al. 2013; Jinek et al. 2013; Mali et al. 2013; Seladi-Schulman 2019). In precedenza, tutti gli esperimenti CRISPR/Cas9 erano stati condotti in vitro, al di fuori degli organismi viventi, in provette o piastre di Petri (Seladi-Schulman 2019).
Un’illustrazione Di Ingegneria Genetica Con CRISPR Cas9

Cosa Succede Durante L’editing Genetico?
È importante che l’effettivo processo di editing genico è più o meno lo stesso per tutti i metodi di editing genico, come mostrato di seguito.
Un’illustrazione dell’editing genetico

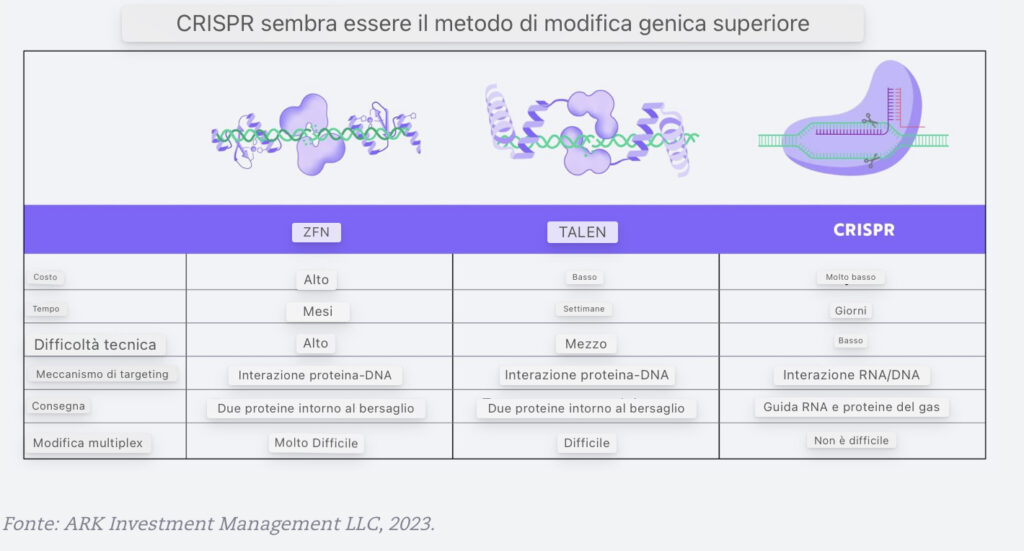
Oggi, CRISPR domina l’editing genetico nella letteratura scientifica e negli studi clinici. Rispetto a ZFN e TALEN, CRISPR è più efficiente, efficace ed economico.
Modifica di base e modifica principale
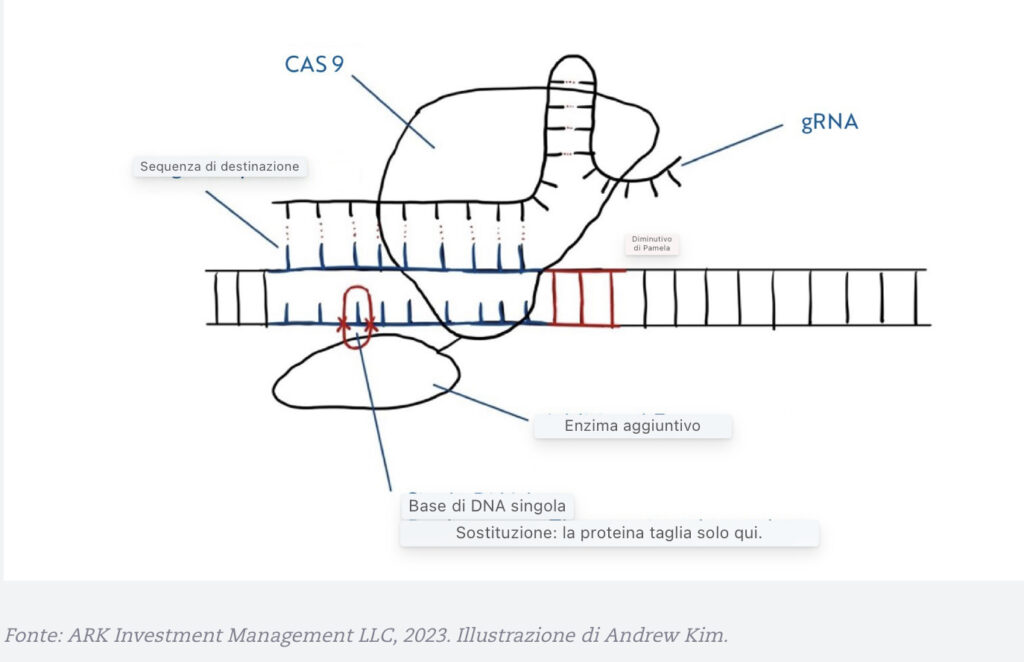
Poiché il rischio associato a CRISPR sono le modifiche fuori target, David Liu e i ricercatori post-dottorato Alexis Komor e Nicole Gaudelli (Komor et al. 2016) hanno costruito su CRISPR/Cas9 e hanno aperto la strada all’editing di base nel 2016. Alterando solo una base in una sequenza di DNA, gli scienziati hanno usato l’editing delle basi per attaccare un altro enzima speciale alla proteina Cas9, prendendo di mira una base specifica in una sequenza e poi passando a un’altra base. Di conseguenza, lo scienziato non ha introdotto DNA estraneo né si è affidato alla riparazione rilevata dall’omologia (HDR, vedi nota 5).
Un’illustrazione Di Editing Di Base
Nel 2019, David Liu e Andrew Anzalone hanno ulteriormente migliorato la funzionalità di CRISPR/Cas9 (Anzalone et al. 2019). Mentre la modifica della base sostituisce una singola base del DNA con ogni passaggio, la modifica del primo consente l’inserimento, la cancellazione e la sostituzione di più basi in un solo passaggio. Piuttosto che limitare l’RNA al suo ruolo di identificatore di una sequenza di DNA corretta, l’editing del primo consente all’RNA di sintetizzare basi di DNA extra su un filamento mirato. In altre parole, il primo editing offre tutti i vantaggi dell’editing di base, senza fare affidamento su HDR o meccanismi di riparazione difettosi, con maggiore flessibilità. Rispetto al tradizionale CRISPR/Cas9, offre più specificità (Anzalone et al. 2019).
Un’illustrazione Di Prime Editing
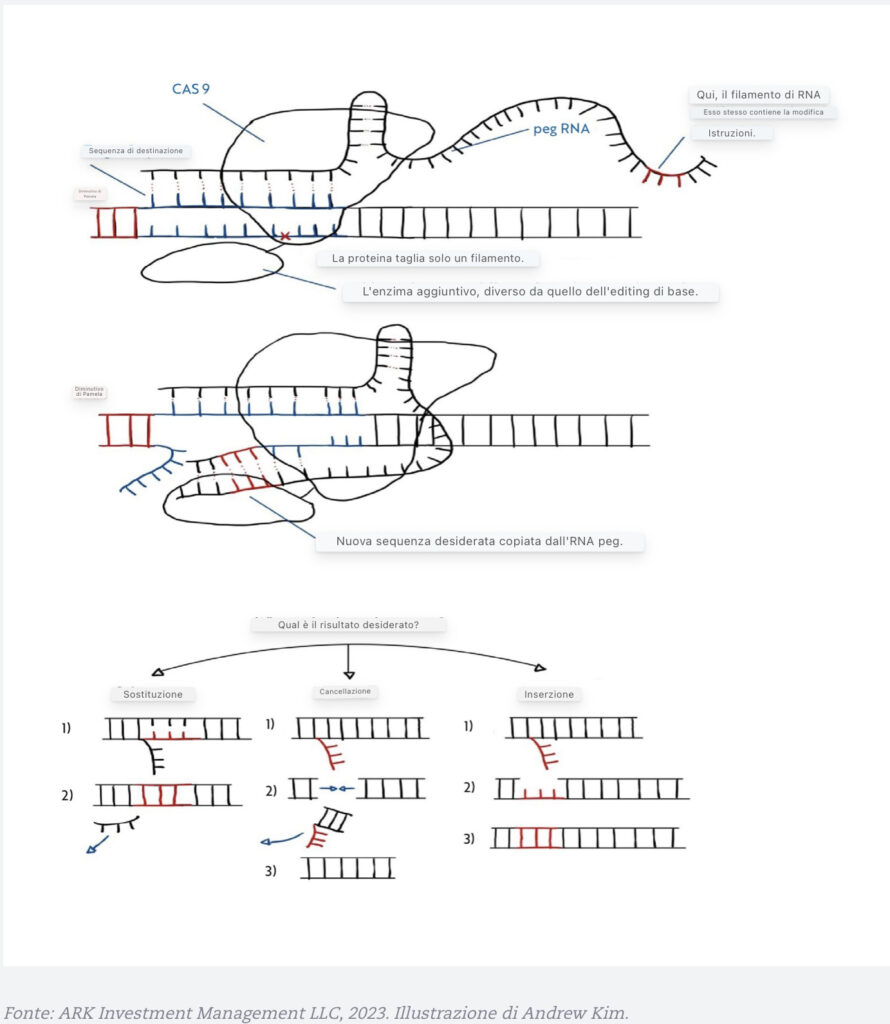
L’editing di base e primo ha chiari vantaggi rispetto ad altri metodi di editing genetico. È importante notare che non tagliano i cromosomi a pezzi e causano rotture del DNA a doppio filamento. Inoltre, mentre il tradizionale CRISPR Cas9 può interrompere i geni, a differenza dell’editing prime e base non può correggerli.
Nella ricerca di cure per le malattie genetiche, CRISPR/Cas9, l’editing di base e l’editing principale sono stati al centro dell’attenzione. Aziende come CRISPR Therapeutics, Caribou Biosciences, Beam Therapeutics e Prime Medicine stanno conducendo studi per discernere come queste tecnologie potrebbero eliminare le malattie genetiche e migliorare la salute umana. I ricercatori dell’Università del Michigan hanno recentemente pubblicato i loro studi sull’uso di CRISPR/Cas9 per colpire le cellule di grasso bruni nei topi nella speranza di prendere di mira l’obesità negli esseri umani (Romanelli et al. 2021). I ricercatori dell’Università di Harvard e del Massachusetts Institute of Technology hanno appena sviluppato un metodo di editing principale chiamato TwinPE che consente agli scienziati di inserire o scambiare interi geni negli esseri umani (Anzalone et al. 2021). Il loro laboratorio ha anche sviluppato il primo modo per basare il DNA mitocondriale (Mok et al. 2020). Quest’anno, la BBC ha riferito che il Great Ormond Street Hospital (GOSH) nel Regno Unito ha dimostrato il potenziale dell’editing di base trattando Alyssa, che aveva la leucemia linfoblastica acuta a cellule T ed è andata in remissione dopo essere stata trattata con i CART modificati dalla base dello studio.[ 6]
Conclusione
Mentre i progressi scientifici negli ultimi quarant’anni hanno reso l’editing genetico più accurato, efficiente ed economico, molte domande, in particolare sull’espressione genica e sui tratti, rimangono senza risposta. Le innovazioni dentro e intorno a CRISPR/Cas9, l’editing di base e l’editing principale hanno migliorato l’editing genetico, lasciando agli scienziati molte interessanti opportunità di mappare le complesse interrelazioni nel genoma umano.
Informazioni importanti
ARK mira a educare gli investitori e a valutare la potenziale opportunità di Disruptive Innovation, notando che i rischi e le incertezze possono avere un impatto su tale innovazione. Il contenuto di questo materiale è solo a scopo informativo ed è soggetto a modifiche senza preavviso. Questo materiale non costituisce, né esplicitamente né implicitamente, alcuna fornitura di servizi o prodotti da parte di ARK e gli investitori sono incoraggiati a consultare consulenti e/o altri professionisti degli investimenti per sapere se un particolare servizio di gestione degli investimenti è adatto alle loro esigenze di investimento. Tutte le dichiarazioni fatte riguardanti società o titoli sono strettamente credenze e punti di vista detenuti da ARK e non sono approvazioni da parte di ARK di alcuna società o titoli o raccomandazioni da parte di ARK per acquistare, vendere o detenere qualsiasi titolo. I risultati storici non sono indicazioni di risultati futuri.
Alcune delle dichiarazioni contenute in questo materiale possono essere dichiarazioni di aspettative future e altre dichiarazioni previsionali che si basano sulle opinioni e ipotesi attuali di ARK e comportano rischi e incertezze noti e sconosciuti che potrebbero far sì che i risultati, le prestazioni o gli eventi effettivi differiscano materialmente da quelli espressi o impliciti in tali dichiarazioni. ARK non si assume alcun obbligo di aggiornare qualsiasi informazione lungimirante contenuta in questo materiale. Alcune informazioni sono state ottenute da fonti che ARK ritiene affidabili; tuttavia, ARK non garantisce l’accuratezza o la completezza di qualsiasi informazione ottenuta da terzi. ARK e i suoi clienti così come le sue persone correlate possono (ma non necessariamente) avere interessi finanziari in aziende che vengono discusse.
©2023, ARK Investment Management LLC. Nessuna parte di questo materiale può essere riprodotta in qualsiasi forma, o menzionata in qualsiasi altra pubblicazione, senza l’espressa autorizzazione scritta di ARK Investment Management LLC (“ARK”).
Opere citate
Ahlgren, N. “Cos’è una proteina? Spiega Un Biologo.” The Conversation.http://theconversation.com/what-is-a-protein-a-biologist-explains-152870.
Anzalone, A.V. et al. 2021. “Eliazione programmabile, sostituzione, integrazione e inversione di grandi sequenze di DNA con Twin Prime Editing”. Biotecnologie della natura. https://doi.org/10.1038/s41587-021-01133-w.
Anzalone, A. et al. 2019. “Cerca e sostituisci l’editing del genoma senza interruzioni a doppio filamento o DNA del donatore”. Natura. www.nature.com, https://doi.org/10.1038/s41586-019-1711-4.
Barrangou, R. et al. 2007 “CRISPR fornisce resistenza acquisita contro i virus nei procarioti.” Scienza. https://doi.org/10.1126/science.1138140.
Bateson, W. 1905. “Nomino ‘Genetics.’” Università di Cambridge. https://exhibitions.lib.cam.ac.uk/linesofthought/artifacts/naming-genetics/.
Baxter, R. 2021. “Tipi di cellule nel corpo umano.” Kenhub. https://www.kenhub.com/en/library/anatomy/types-of-cells-in-the-human-body.
Berkowitz, J. 2015. “Questa Color Chart Lego Contiene Ogni Colore Lego Che Esiste”. Fast Company. https://www.fastcompany.com/3054307/this-lego-color-chart-contains-every-color-lego-ever.
Bhattacharyya, N.P. 2008. “La malattia di Huntington: un disturbo monogenico con complessità cellulari e biochimiche”. Il FEBS Journal. https://doi.org/10.1111/j.1742-4658.2008.06560.x.
Bogdanove, A. J. e D.F. Voytas. 2011. “ETAL Effectors: proteine personalizzabili per il targeting del DNA”. Scienza. https://doi.org/10.1126/science.1204094.
Bulmer, M. 1999. “Lo sviluppo delle idee di Francis Galton sul meccanismo dell’ereditarietà”. Giornale di Storia della Biologia. https://www.jstor.org/stable/4331525
Calyxt 2021. “Calyxt riporta i risultati finanziari del quarto trimestre e dell’intero anno 2020”. https://calyxt.com/calyxt-reports-fourth-quarter-and-full-year-2020-financial-results/.
Christian, M. et al. 2010. “Il targeting del DNA Double-Strand si rompe con le nucleosi effettrici TAL”. Genetica. https://doi.org/10.1534/genetics.110.120717.
Clancy, S. e W. Marrone. 2008. “Traduzione: da DNA a mRNA a proteine”, Nature Education.https://www.nature.com/scitable/topicpage/translation-dna-to-mrna-to-protein-393/.
Cohen, J. 2020. “Il nuovo metodo per modificare il DNA della “centrale elettrica” della cellula potrebbe aiutare a studiare la varietà di malattie genetiche”. Scienza. https://www.science.org/content/article/new-method-edit-cell-s-powerhouse-dna-could-help-study-variety-genetic-diseases.
Cohen, P. E. 2018. “Panoramica della meiosis.” Enciclopedia della riproduzione, 2a edizione. A cura di M.K. Skinner. Stampa accademica. https://doi.org/10.1016/B978-0-12-801238-3.64701-3.
Cong, L. et al. 2013. “Ingegneria del genoma multiplex utilizzando sistemi CRISPR/Cas”. Scienza. https://doi.org/10.1126/science.1231143.
Cornu, T.I. et al. 2008. “La specificità che legna il DNA è un determinante principale dell’attività e della tossicità delle nucleoasi di zinco-dita”. Terapia molecolare. https://doi.org/10.1038/sj.mt.6300357.
Dizionario NCI dei termini del cancro. 2011. “Definizione di cellula.” https://www.cancer.gov/publications/dictionaries/cancer-terms/def/cell.
Deltcheva, E. et al. 2011. “Maturazione dell’RNA CRISP per piccolo RNA transcodificato e fattore ospite RNasi III”. Natura. https://doi.org/10.1038/nature09886.
Drummond D.A. e C.O Wilke. 2009. “Le conseguenze evolutive della sintesi proteica errata.” Recensioni della natura, genetica. https://www.nature.com/articles/nrg2662
Epinat, J. et al. 2003. “Una nuova Meganucleasi ingegnerizzata induce una ricombinazione omologa nel lievito e nelle cellule di mammifero”. Ricerca sugli acidi nucleici. https://doi.org/10.1093/nar/gkg375.
Gasiunas, G. et al. 2012. “Il complesso Ribonucleoproteina Cas9-CrRNA media la scissione specifica del DNA per l’immunità adattiva nei batteri”. Atti dell’Accademia Nazionale delle Scienze. https://doi.org/10.1073/pnas.1208507109.
Haun, W. et al. 2014. “Migliorata la qualità dell’olio di soia grazie alla mutagenesi mirata della famiglia di geni della desaturasi 2 degli acidi grassi”. Plant Biotechnology Journal. https://doi.org/10.1111/pbi.12201.
Henninger, J. 2012. “Il 99 per cento… del genoma umano.” La scienza nelle notizie. https://sitn.hms.harvard.edu/flash/2012/issue127a/.
Hoy, M.A. 2013. “Capitolo 9 – Vettori di elementi trasponibili e altri metodi per modificare geneticamente la drosofila e altri insetti.” Genetica molecolare degli insetti, 3a edizione. Stampa accademica. https://doi.org/10.1016/B978-0-12-415874-0.00009-3.
Istituto nazionale di ricerca sul genoma umano. 2020. “FAQ sul progetto del genoma umano.” https://www.genome.gov/human-genome-project/Completion-FAQ.
Hummer, K.E. et al. 2009. “Decapoligia in Fragaria Iturupensis (Rosaceae).” American Journal of Botany. https://doi.org/10.3732/ajb.0800285.
Jaenisch, R. e B. Mintz. 1974. “Virus della Sisimian 40 sequenze di DNA nel DNA di topi adulti sani derivate da blastocisti preimpianto iniettate con DNA virale”. Atti della National Academy of Sciences degli Stati Uniti d’America. https://doi.org/10.1073/pnas.71.4.1250.
Jinek, M. et al. 2012. “Una endonucleasi del DNA guidata da doppio RNA programmabile nell’immunità batterica adattiva”. Scienza. https://doi.org/10.1126/science.1225829.
Jinek, M. et al. 2013. “Modifica del genoma programmata con RNA nelle cellule umane”. ELife, Volume 2. A cura di D. Weigelhttps://doi.org/10.7554/eLife.00471.
Kim, H.J. et al. 2009. “Editura mirata del genoma in cellule umane con nucleosi delle dita di zinco costruite tramite assemblaggio modulare”. Ricerca sul genoma. https://doi.org/10.1101/gr.089417.108.
Klug, A. 2010. “La scoperta delle dita di zinco e delle loro applicazioni nella regolazione genica e nella manipolazione del genoma”. Revisione annuale della biochimica. https://doi.org/10.1146/annurev-biochem-010909-095056.
Komor, A.C. et al. 2016. “Modifica programmabile di una base bersaglio nel DNA genomico senza scissione del DNA a doppio filamento”. Natura. https://doi.org/10.1038/nature17946.
Lobo, I. 2008. “La Pleiotropia Non È Eredità Poligenica”. Educazione alla natura. https://www.nature.com/scitable/topicpage/pleiotropy-one-gene-can-affect-multiple-traits-569/.
Cellectis. 2021. “Principali candidati al prodotto.” https://www.cellectis.com/en/products/product-candidates. Accesso effettuato il 18 dicembre 2021.
Mali, P. et al. 2013. “Ingegneria del genoma umano guidata dall’RNA tramite Cas9.” Scienza, vol. 339, n. 6121, Associazione americana per l’avanzamento della scienza. https://doi.org/10.1126/science.1232033.
Martello G. e A. Smith. 2016. “La natura delle cellule staminali embrionali.” Revisione annuale della biologia cellulare e dello sviluppo. https://www.annualreviews.org/doi/10.1146/annurev-cellbio-100913-013116
Martinez-Lage, M. et al. 2017. “Capitolo due – Tecnologia CRISPR/Cas9: applicazioni e modellazione delle malattie umane.” Progressi nella biologia molecolare e nelle scienze traslazionali. A cura di R.Torres-Ruiz e S. Rodriguez-Perales. Stampa accademica. https://doi.org/10.1016/bs.pmbts.2017.09.002.
Masood, Q.F. et al. 2016. “Ricombinazione omologo.” Enciclopedia Britannica. https://www.britannica.com/science/homologous-recombination.
Mojica, F. J. et al. 2000. “Significa biologica di una famiglia di ripetizioni regolarmente distanziate nei genomi di archei, batteri e mitocondri”. Microbiologia molecolare.https://doi.org/10.1046/j.1365-2958.2000.01838.x.
Mok, B. et al. 2020. “Una tossina batterica della citidina deaminasi consente l’editing della base mitocondriale senza CRISPR”. Natura. https://www.nature.com/articles/s41586-020-2477-4.
O’Hanlon Cohrt, K. 2021. “Aggiornamento della sperimentazione clinica – Terapie a cellule T CAR a modifica della Meganucleasi.” CRISPR Medicine News. https://crisprmedicinenews.com/news/clinical-trial-update-meganuclease-edited-car-t-cell-therapies/.
Paques, F. e P. Duchateau. 2007. “Meganucleasi e ricombinazione indotta dalla rottura a doppio filamento del DNA: prospettive per la terapia genica”. Terapia genica attuale. https://doi.org/10.2174/156652307779940216.
Paschon, D. E. et al. 2019. “Diversificare la struttura delle nucleosi delle dita di zinco per l’editing del genoma ad alta precisione”. Nature Communications. https://doi.org/10.1038/s41467-019-08867-x.
Philippidis, A. 2021. “Sangamo, Sanofi mostrano dati precoci positivi per la terapia cellulare modificata dal gene SCD”. GEN – Notizie di ingegneria genetica e biotecnologia. https://www.genengnews.com/news/sangamo-sanofi-show-positive-early-data-for-scd-gene-edited-cell-therapy/.
Prega, L. 2008. “Scoperta di DNA Double Helix: Watson e Crick”. Educazione alla natura. http://www.nature.com/scitable/topicpage/discovery-of-dna-structure-and-function-watson-397.
Romanelli, S. M. et al. 2021. “BAd-CRISPR: Knockout genico inducibile nel tessuto adiposo marrone interscapolare di topi adulti.” Il Journal of Biological Chemistry. https://doi.org/10.1016/j.jbc.2021.101402.
Seladi-Schulman, J. 2019. “In Vivo vs. In Vitro: cosa significa tutto questo?” Healthline. https://www.healthline.com/health/in-vivo-vs-in-vitro.
Shrivastava, S. et al. 2021. “Repressione epigenetica stabile dell’HIV-1 mediata dall’esosoma”. Nature Communications. www.nature.com, https://doi.org/10.1038/s41467-021-25839-2.
Istituto nazionale di ricerca sul genoma umano. 2021. “Ripetuta in tandem.” Accesso effettuato il 18 dicembre 2021. https://www.genome.gov/genetics-glossary/Tandem-Repeat.
NobelPrize.Org. 2020. “Il premio Nobel per la chimica 2020.” https://www.nobelprize.org/prizes/chemistry/2020/press-release/.
NobelPrize.Org. 2007. “Il premio Nobel per la fisiologia o la medicina 2007.”https://www.nobelprize.org/prizes/medicine/2007/summary/.
Thomas K.R. e M.R. Capecchi. 1987. “La mutagenesi diretta al sito mediante targeting genico nelle cellule staminali derivate dall’embrione di topo”, Cell. 503-12, doi:10.1016/0092-8674(87)90646-5.
Tröder, S. E. e B. Zevnik. 2021. “Storia dell’editing del genoma: dalle Meganucleasi al CRISPR”. Animali da laboratorio. PubMed, https://doi.org/10.1177/0023677221994613.
Vertex Pharmaceuticals (Canada) Incorporated. 2018. “Lumacaftor/Ivacaftor (Orkambi): (Vertex Pharmaceuticals (Canada) Incorporated): Indicazione: per il trattamento della fibrosi cistica in pazienti di età pari o superiore a sei anni che sono omozigoti per la mutazione F508del nel gene regolatore della conduttanza transmembrana della fibrosi cistica [Internet].” Rapporto di revisione clinica: Lumacaftor/Ivacaftor (Orkambi): (Vertex Pharmaceuticals (Canada) Incorporated): Indicazione: per il trattamento della fibrosi cistica in pazienti di età pari o superiore a sei anni che sono omozigoti per la mutazione F508del nel gene regolatore di conduttanza transmembrana della fibrosi cistica 2018. www.ncbi.nlm.nih.gov, https://www.ncbi.nlm.nih.gov/books/NBK540352/.
Vidyasagar, A. e N. Lanse. 2021. “Cos’è CRISPR?” Live Science. https://www.livescience.com/58790-crispr-explained.html.
EUFIC. 2019. “Cosa sono le proteine e qual è la loro funzione nel corpo?” https://www.eufic.org/en/whats-in-food/article/what-are-proteins-and-what-is-their-function-in-the-body.
Winikates, K. 2012. “Gene del regolatore di conduttanza transmembrana della fibrosi cistica (CFTR).” The Embryo Project Encyclopedia. https://embryo.asu.edu/pages/cystic-fibrosis-transmembrane-conductance-regulator-cftr-gene.
Woolf, T.M. 1998. “Riparazione terapeutica di sequenze di acido nucleico mutato”. Biotecnologie della natura. www.nature.com, https://doi.org/10.1038/nbt0498-341.
Yeadon, J. 2014. “Pro e contro di ZNF, TALEN e CRISPR/Cas.” Il laboratorio Jackson. https://www.jax.org/news-and-insights/jax-blog/2014/march/pros-and-cons-of-znfs-talens-and-crispr-cas.
- 1Questa breve storia sottorappresenta la natura piena e sfumata delle scoperte e delle centinaia di scienziati coinvolti.
- 2Le citazioni utilizzate in questa illustrazione semplificata non sono citazioni reali degli individui rappresentati.
- 3Questa sezione delinea le informazioni minime necessarie per comprendere l’editing genetico. Si incoraggiano ulteriori letture su ciascuno dei termini.
- 4Le cellule sessuali sono l’unica eccezione: gli spermatozoi e gli ovociti contengono solo una copia di ciascun cromosoma per un totale di 23 singoli filamenti. Dopo una fecondazione di successo, lo sperma e l’ovulo si fondono per creare 46 fili individuali: 23 dalla madre, 23 dal padre.
- 5I primi metodi di ricombinazione omologa utilizzavano cellule staminali embrionali di topi, in cui sarebbe stato inserito il DNA bersaglio. Dopo una ricombinazione omologa riuscita, le cellule staminali embrionali modificate sono state poi inserite negli embrioni precoci di topi normali. Quindi, gli stessi embrioni modificati verrebbero impiantati nei topi ospiti femmine. Infine, quei topi modificati si riprodurebbero per produrre prole, trasmettendo il gene modificato. Questa deviazione utilizzando le cellule staminali embrionali è dispendiosa in termini di tempo e costosa e include diversi altri passaggi non delineati qui (Thomas e Capecchi 1987; Martello e Smith 2016).
- 6https://www.cancer.gov/publications/dictionaries/cancer-terms/def/car-t-cell-therapyUn tipo di trattamento in cui le cellule T di un paziente (un tipo di cellula del sistema immunitario) vengono cambiate in laboratorio in modo che attacchino le cellule tumorali. Istituto Nazionale del Cancro.